Bacilo
Los bacilos son bacterias que tienen forma de bastón, cuando se observan al microscopio.
Los bacilos se suelen dividir en:
• Bacilos Gram positivos: fijan el violeta de genciana (tinción de Gram) en la pared celular porque carecen de capa de lipopolisacárido.
• Bacilos Gram negativos: no fijan el violeta de genciana porque poseen la capa de lipopolisacárido (peptidoglicano).
Aunque muchos bacilos son patógenos para el ser humano, algunos no hacen daño, pues son los encargados de producir algunos productos lácteos como el yogurt (lactobacilos).
Coco (bacteria)
Coco, tipo morfológico de bacteria. Tiene forma más o menos esférica (ninguna de sus dimensiones predomina claramente sobre las otras).
• Diplococo: estos cocos se dividen en un sólo plano formando parejas, y dan la impresión de un grano de café, entre éstos podemos citar a los meningococos y gonococos.
Algunos ocasionan enfermedades a los humanos (Ej:neumococo y estafilococo) también es causante de enfermedades como el de la meningitis, otros resultan inocuos o incluso beneficiosos.
Los cocos se dividen en:
• Diplococos: Son pares.
• Estreptococos: En cadena.
• Estafilococos: En racimo.
• Tetradas: En número de 4.
• Sarcinas: En paquetes.
lunes, 22 de junio de 2009
INVESTIGACION NO. 6 ELABORACION DE UN FROTIS BACTERIANO
Preparación de un frotis bacteriano
________________________________________
Se denomina frotis a la extensión que se realiza sobre un portaobjetos de una muestra o cultivo con objeto de separar lo más posible los microorganismos, ya que si aparecen agrupados en la preparación es muy difícil obtener una imagen clara y nítida. Este frotis debe ser posteriormente fijado al vidrio del portaobjetos para poder aplicar los métodos habituales de tinción que permiten la observación al microscopio de las bacterias sin que la muestra sea arrastrada en los sucesivos lavados. La fijación de una extensión bacteriana hace que las bacterias queden inactivadas y adheridas al vidrio alterando lo menos posible la morfología y bacteriana y las posibles agrupaciones de células que pudiera haber.
REALIZACIÓN DEL FROTIS
1. Colocar una pequeña gota de agua en el centro de un portaobjetos limpio. Es necesaria muy poca cantidad de agua, por lo que se puede usar el asa de siembra, ya que en el extremo curvo de su filamento queda retenida una mínima gota de agua, que resulta suficiente.
2. Flamear el asa de siembra, tomar, en condiciones asépticas, una pequeña cantidad del cultivo bacteriano en medio sólido y transferirlo a la gota de agua. Remover la mezcla con el asa de siembra hasta formar una suspensión homogénea que quede bastante extendida para facilitar su secado.
Si la muestra se toma de un cultivo en medio líquido, no es necesario realizar los dos primeros pasos ya que basta con colocar y extender una gota de la suspensión bacteriana, que se toma con el asa de siembra, directamente sobre el portaobjetos.
3. Esperar hasta que el líquido se evapore o acelerar su evaporación acercando el porta a la llama del mechero. En este caso hay que tener mucha precaución de no calentar demasiado el porta pues las células pueden deformarse o romperse.
FIJACIÓN DE LAS BACTERIAS AL PORTAOBJETOS
4. Por calor: Pasar tres veces el portaobjetos por la llama durante unos segundos. Dejar enfriar el porta entre los pases.
5. Con metanol (para bacterias procedentes de medio líquido). Añadir unas gotas de metanol sobre la extensión completamente seca. Golpear el portaobjetos por su canto con cuidado contra la mesa de trabajo para retirar de inmediato el exceso de metanol. Esperar a que el metanol se evapore completamente.
Una vez realizado el frotis y fijadas las bacterias, las preparaciones pueden ser observadas al microscopio, aunque carecen de contraste. Lo normal es continuar con el proceso de tinción.
Bibliografía: www.Joseacortes.com
________________________________________
Se denomina frotis a la extensión que se realiza sobre un portaobjetos de una muestra o cultivo con objeto de separar lo más posible los microorganismos, ya que si aparecen agrupados en la preparación es muy difícil obtener una imagen clara y nítida. Este frotis debe ser posteriormente fijado al vidrio del portaobjetos para poder aplicar los métodos habituales de tinción que permiten la observación al microscopio de las bacterias sin que la muestra sea arrastrada en los sucesivos lavados. La fijación de una extensión bacteriana hace que las bacterias queden inactivadas y adheridas al vidrio alterando lo menos posible la morfología y bacteriana y las posibles agrupaciones de células que pudiera haber.
REALIZACIÓN DEL FROTIS
1. Colocar una pequeña gota de agua en el centro de un portaobjetos limpio. Es necesaria muy poca cantidad de agua, por lo que se puede usar el asa de siembra, ya que en el extremo curvo de su filamento queda retenida una mínima gota de agua, que resulta suficiente.
2. Flamear el asa de siembra, tomar, en condiciones asépticas, una pequeña cantidad del cultivo bacteriano en medio sólido y transferirlo a la gota de agua. Remover la mezcla con el asa de siembra hasta formar una suspensión homogénea que quede bastante extendida para facilitar su secado.
Si la muestra se toma de un cultivo en medio líquido, no es necesario realizar los dos primeros pasos ya que basta con colocar y extender una gota de la suspensión bacteriana, que se toma con el asa de siembra, directamente sobre el portaobjetos.
3. Esperar hasta que el líquido se evapore o acelerar su evaporación acercando el porta a la llama del mechero. En este caso hay que tener mucha precaución de no calentar demasiado el porta pues las células pueden deformarse o romperse.
FIJACIÓN DE LAS BACTERIAS AL PORTAOBJETOS
4. Por calor: Pasar tres veces el portaobjetos por la llama durante unos segundos. Dejar enfriar el porta entre los pases.
5. Con metanol (para bacterias procedentes de medio líquido). Añadir unas gotas de metanol sobre la extensión completamente seca. Golpear el portaobjetos por su canto con cuidado contra la mesa de trabajo para retirar de inmediato el exceso de metanol. Esperar a que el metanol se evapore completamente.
Una vez realizado el frotis y fijadas las bacterias, las preparaciones pueden ser observadas al microscopio, aunque carecen de contraste. Lo normal es continuar con el proceso de tinción.
Bibliografía: www.Joseacortes.com
INVESTIGACION NO.5
McConkey agar
Medio diferencial para la detección, aislamiento y enumeración de bacterias coniformes y patógenas intestinales en aguas, productos lácteos y muestras biológicas. Su acción diferencial esta basada en que los microorganismos capaces de fermentar lactosa producen una caída de pH, junto con una absorción del colorante, apareciendo en la colonia el color rosa, las colonias de microorganismos que no fermentan la lactosa permanecen incoloras.
Kligler Hierro Agar.
Medio de cultivo frecuentemente usado en microbiología de alimentos para la diferenciación de enterobacterias, en base a la fermentación de glucosa y lactosa, y a la producción de ácido sulfhídrico.
• Caldo Nutriente:
Medio de uso general, utilizado para el crecimiento de microorganismos exigentes así como para los no exigentes. Clostridios y anaerobios pueden crecer también cuando se incuban bajo condiciones de anaerobiosis.
• Agar Sangre:
Medio de propósito general para el cultivo de una gran variedad de microorganismos incluyendo los exigentes. Al añadirle sangre, puede utilizarse para la determinación de las reacciones hemolíticas. El medio esta libre de azucares reductores, ya que estos influirían de forma adversa en reacciones hemolíticas.
• Agar Nutritivo:
Medio para fines generales que promueve el crecimiento de la mayoría de los microorganismos poco exigentes.
• Agar Levine:
Medio para el aislamiento y la diferenciación de los Escherichia coli y enterobacterias, fermentadores de lactosa y no fermentadores de lactosa y para la identificación rápida de los albicans.
• Agar Chapman:
Medio para la detección de Staphylococcus patógenos en muestras de alimentos y otros materiales mediante la técnica de filtración por membrana.
• Agar Papa Dextrosa:
Medio para el cultivo y enumeración de levaduras y mohos a partir de alimentos y otros materiales. Los hidratos de carbono y la infusión de papa favorecen el crecimiento de levaduras y hongos, en tanto que por el bajo rango de pH, la flora acompañante se reduce significativamente.
• Agar Salmonella-Shigella:
Medio para el aislamiento de salmonellas y de Shigella de heces, de comestibles y de otros materiales.
• Agar Sabouraud:
Medio para la detección y aislamiento de hongos en muestras mediante técnica de filtración por membrana. Para que ocurra el crecimiento selectivo de hongos sobre bacterias en la muestra depende tan solo de la reacción ácida (pH 5.6).
Agar Chocolate
El agar sangre y el agar chocolate son los medios más frecuentemente empleados en el laboratorio. Son medios generales en los que crecen la mayor parte de las bacterias patógenas. Constan de un medio base de nutrientes, agar y sangre de caballo o carnero que constituye un suplemento nutricional para el cultivo. La única diferencia entre ambos es que en el agar chocolate la sangre está hemolizada de modo que todos los factores nutricionales, tanto extra como intraeritrocitarios están a disposición de los microorganismos. Por eso el agar chocolate puede considerarse como de enriquecimiento en relación con el agar sangre. Haemophylus influenzae es un bacilo gram negativo exigente que necesita de factores intraeritrocitarios para crecer y atmósfera rica en CO2. No crece en agar sangre y si en agar chocolate incubado en alta concentración de CO2.
Mueller- Hinton Agar
Este medio de cultivo ha sido recomendado universalmente para la prueba de sensibilidad a los antimicrobianos. Además es útil con el agregado de sangre para el cultivo y aislamiento de microorganismos nutricionalmente exigentes.
Medio diferencial para la detección, aislamiento y enumeración de bacterias coniformes y patógenas intestinales en aguas, productos lácteos y muestras biológicas. Su acción diferencial esta basada en que los microorganismos capaces de fermentar lactosa producen una caída de pH, junto con una absorción del colorante, apareciendo en la colonia el color rosa, las colonias de microorganismos que no fermentan la lactosa permanecen incoloras.
Kligler Hierro Agar.
Medio de cultivo frecuentemente usado en microbiología de alimentos para la diferenciación de enterobacterias, en base a la fermentación de glucosa y lactosa, y a la producción de ácido sulfhídrico.
• Caldo Nutriente:
Medio de uso general, utilizado para el crecimiento de microorganismos exigentes así como para los no exigentes. Clostridios y anaerobios pueden crecer también cuando se incuban bajo condiciones de anaerobiosis.
• Agar Sangre:
Medio de propósito general para el cultivo de una gran variedad de microorganismos incluyendo los exigentes. Al añadirle sangre, puede utilizarse para la determinación de las reacciones hemolíticas. El medio esta libre de azucares reductores, ya que estos influirían de forma adversa en reacciones hemolíticas.
• Agar Nutritivo:
Medio para fines generales que promueve el crecimiento de la mayoría de los microorganismos poco exigentes.
• Agar Levine:
Medio para el aislamiento y la diferenciación de los Escherichia coli y enterobacterias, fermentadores de lactosa y no fermentadores de lactosa y para la identificación rápida de los albicans.
• Agar Chapman:
Medio para la detección de Staphylococcus patógenos en muestras de alimentos y otros materiales mediante la técnica de filtración por membrana.
• Agar Papa Dextrosa:
Medio para el cultivo y enumeración de levaduras y mohos a partir de alimentos y otros materiales. Los hidratos de carbono y la infusión de papa favorecen el crecimiento de levaduras y hongos, en tanto que por el bajo rango de pH, la flora acompañante se reduce significativamente.
• Agar Salmonella-Shigella:
Medio para el aislamiento de salmonellas y de Shigella de heces, de comestibles y de otros materiales.
• Agar Sabouraud:
Medio para la detección y aislamiento de hongos en muestras mediante técnica de filtración por membrana. Para que ocurra el crecimiento selectivo de hongos sobre bacterias en la muestra depende tan solo de la reacción ácida (pH 5.6).
Agar Chocolate
El agar sangre y el agar chocolate son los medios más frecuentemente empleados en el laboratorio. Son medios generales en los que crecen la mayor parte de las bacterias patógenas. Constan de un medio base de nutrientes, agar y sangre de caballo o carnero que constituye un suplemento nutricional para el cultivo. La única diferencia entre ambos es que en el agar chocolate la sangre está hemolizada de modo que todos los factores nutricionales, tanto extra como intraeritrocitarios están a disposición de los microorganismos. Por eso el agar chocolate puede considerarse como de enriquecimiento en relación con el agar sangre. Haemophylus influenzae es un bacilo gram negativo exigente que necesita de factores intraeritrocitarios para crecer y atmósfera rica en CO2. No crece en agar sangre y si en agar chocolate incubado en alta concentración de CO2.
Mueller- Hinton Agar
Este medio de cultivo ha sido recomendado universalmente para la prueba de sensibilidad a los antimicrobianos. Además es útil con el agregado de sangre para el cultivo y aislamiento de microorganismos nutricionalmente exigentes.
INVESTIGACION DE PARATIFOIDEA
Paratifoidea
El agente causal de la fiebre paratifoidea eso Salmonella paratyphi tipos A, B y C (que causan cuadros más leves). El tiempo de incubación de la enfermedad varía de 3 a 21 días, dependiendo del inóculo, de la edad, de la salud y de otras características del paciente.
Aparecen escalofríos, cefalea, náuseas, anorexia, tos y diarrea o estreñimiento. La fiebre es prolongada y varía de 38,5ºC a 40ºC. Entre un 20 y un 40 % de los casos presentan dolor abdominal.
El agente causal de la fiebre paratifoidea eso Salmonella paratyphi tipos A, B y C (que causan cuadros más leves). El tiempo de incubación de la enfermedad varía de 3 a 21 días, dependiendo del inóculo, de la edad, de la salud y de otras características del paciente.
Aparecen escalofríos, cefalea, náuseas, anorexia, tos y diarrea o estreñimiento. La fiebre es prolongada y varía de 38,5ºC a 40ºC. Entre un 20 y un 40 % de los casos presentan dolor abdominal.
INVESTIGACION DE TIFOIDEA
Tifoidea
La fiebre tifoidea o fiebre entérica es una enfermedad infecciosa producida por Salmonella typhi (bacilo de Eberth), o Salmonella paratyphi A, B o C. Su reservorio es el hombre, y el mecanismo de contagio es fecal-oral, a través de agua y de alimentos contaminados con deyecciones.
En el período de incubación, que dura de 10 a 15 días, se aprecian trastornos del estado general, una fase de bacteriemia con fiebre que aumenta progresivamente hasta alcanzar 39-40 ºC, en cuyo momento se mantiene, cefalea, estupor, roséola en el vientre, tumefacción de la mucosa nasal, lengua tostada, úlceras en el paladar y, a veces, hepatoesplenomegalia y diarrea.
La fiebre tifoidea o fiebre entérica es una enfermedad infecciosa producida por Salmonella typhi (bacilo de Eberth), o Salmonella paratyphi A, B o C. Su reservorio es el hombre, y el mecanismo de contagio es fecal-oral, a través de agua y de alimentos contaminados con deyecciones.
En el período de incubación, que dura de 10 a 15 días, se aprecian trastornos del estado general, una fase de bacteriemia con fiebre que aumenta progresivamente hasta alcanzar 39-40 ºC, en cuyo momento se mantiene, cefalea, estupor, roséola en el vientre, tumefacción de la mucosa nasal, lengua tostada, úlceras en el paladar y, a veces, hepatoesplenomegalia y diarrea.
INVESTIGACION DE SALMONELOSIS
Salmonelosis:
La salmonelosis humana es una enfermedad infectocontagiosa producida por enterobacterias del género Salmonella. Comprende un conjunto de cuadros clínicos cuya principal manifestación es la gastroenteritis aguda, una de las intoxicaciones alimentarias más comunes causadas por agua y alimentos contaminados, especialmente carnes. Tanto salmonelosis como el género Salmonella son una latinización del nombre de Daniel Elmer Salmon (1850-1914), un veterinario estadounidense.
Síntomas:
Por lo general los síntomas aparecen entre las 6 a 48 horas, después de haber ingerido alimentos contaminados y habitualmente el malestar suele durar entre 1 a 4 días. Algunos tipos suelen ser muy peligrosos como el que ocasiona la fiebre tifoidea.
Entre los síntomas de la enfermedad están:
- Diarrea leve o persistente.
- Fiebre alta.
- Náuseas y vómitos en algunos casos.
- Dolor abdominal.
- Malestar general.
La salmonelosis humana es una enfermedad infectocontagiosa producida por enterobacterias del género Salmonella. Comprende un conjunto de cuadros clínicos cuya principal manifestación es la gastroenteritis aguda, una de las intoxicaciones alimentarias más comunes causadas por agua y alimentos contaminados, especialmente carnes. Tanto salmonelosis como el género Salmonella son una latinización del nombre de Daniel Elmer Salmon (1850-1914), un veterinario estadounidense.
Síntomas:
Por lo general los síntomas aparecen entre las 6 a 48 horas, después de haber ingerido alimentos contaminados y habitualmente el malestar suele durar entre 1 a 4 días. Algunos tipos suelen ser muy peligrosos como el que ocasiona la fiebre tifoidea.
Entre los síntomas de la enfermedad están:
- Diarrea leve o persistente.
- Fiebre alta.
- Náuseas y vómitos en algunos casos.
- Dolor abdominal.
- Malestar general.
PRACTICA 9. AGLUTINACION EN SANGRE
Objetivo
El objetivo de esta práctica es realizar la prueba de aglutinación en sangre fresca para realizar el análisis de tipos sanguíneos, haciendo una observación macroscópica de la aglutinación.
Introducción
Vamos a hacer una prueba aglutinación en sangre fresca, utilizando el tubo con tapón morado que contiene anticoagulante, tipificadores anti- A, anti- B y anti-D color amarillo, azul y transparente respectivamente, punteando la sangre sobre la placa excavada.
Índice
1. Objetivo
2. Introducción
3. Marco teórico
*Desarrollo
*Bitácora
*Cuadro
4.- Conclusión
Marco Teórico
Materiales:
Placa excavada de porcelana
Palillos de madera
Tubo de ensaye de tapón morado con anticoagulante
Torniquete
Jeringa hipodérmica desechable de 5 ml
Torundas de algodón alcoholizadas
Torundas de algodón secas
Papel para cubrir mesa
Gradilla
Reactivos tipificadores anti-A, anti-B y anti-D
Desarrollo
Se tomara la muestra de sangre y se colocara en el tubo de ensaye con tapón morado y anticoagulante.
Se puntea en la placa excavada con la pipeta Pasteur y se le colocaran los tipificadores anti-A, anti-B y anti-D
Se mezclara la sangre con el tipificador, utilizando los palillos de madera, después se harán movimientos en rotación y traslación para observar la aglutinación y darna cuenta si la sangre es tipo positivo o negativo.
Una vez terminado deberemos limpiar las pipetas para que la sangre no se pegue, ya que si lo hace deberemos tirarla. Nos desharemos de los materiales de acuerdo a la Nom-087.
Bitácora
Actividad Tiempo
Toma de muestra 10 min
Punteo y mezcla de sangre con tipificadores 5 min.
Observación macroscópica 5 min.
Conclusión
Sí logramos observar la aglutinación que se producía al mezclar la sangre con los tipificadores anti-A, anti-B y anti-D, en ambos pacientes hubo una aglutinación notoria en el tipificador anti-A y lo observado es el resultado de que ambos pacientes tienen un RH positivo.
El objetivo de esta práctica es realizar la prueba de aglutinación en sangre fresca para realizar el análisis de tipos sanguíneos, haciendo una observación macroscópica de la aglutinación.
Introducción
Vamos a hacer una prueba aglutinación en sangre fresca, utilizando el tubo con tapón morado que contiene anticoagulante, tipificadores anti- A, anti- B y anti-D color amarillo, azul y transparente respectivamente, punteando la sangre sobre la placa excavada.
Índice
1. Objetivo
2. Introducción
3. Marco teórico
*Desarrollo
*Bitácora
*Cuadro
4.- Conclusión
Marco Teórico
Materiales:
Placa excavada de porcelana
Palillos de madera
Tubo de ensaye de tapón morado con anticoagulante
Torniquete
Jeringa hipodérmica desechable de 5 ml
Torundas de algodón alcoholizadas
Torundas de algodón secas
Papel para cubrir mesa
Gradilla
Reactivos tipificadores anti-A, anti-B y anti-D
Desarrollo
Se tomara la muestra de sangre y se colocara en el tubo de ensaye con tapón morado y anticoagulante.
Se puntea en la placa excavada con la pipeta Pasteur y se le colocaran los tipificadores anti-A, anti-B y anti-D
Se mezclara la sangre con el tipificador, utilizando los palillos de madera, después se harán movimientos en rotación y traslación para observar la aglutinación y darna cuenta si la sangre es tipo positivo o negativo.
Una vez terminado deberemos limpiar las pipetas para que la sangre no se pegue, ya que si lo hace deberemos tirarla. Nos desharemos de los materiales de acuerdo a la Nom-087.
Bitácora
Actividad Tiempo
Toma de muestra 10 min
Punteo y mezcla de sangre con tipificadores 5 min.
Observación macroscópica 5 min.
Conclusión
Sí logramos observar la aglutinación que se producía al mezclar la sangre con los tipificadores anti-A, anti-B y anti-D, en ambos pacientes hubo una aglutinación notoria en el tipificador anti-A y lo observado es el resultado de que ambos pacientes tienen un RH positivo.
PRACTICA 8. AGLUTINACION EN SUERO SANGUINEO
*Objetivo
Esta práctica tiene como objetivo que el alumno de laboratorio de análisis clínicos aprenda a realizar una prueba de aglutinación en suero sanguíneo, utilizando los instrumentos de laboratorio, equipo científico y reactivo para alcanzar su objetivo en la elaboración de un examen clínico denominado reacciones febriles, dando la oportunidad de investigar microorganismos bacteriológicos.
*Introducción
En esta practica se llevara a cabo la técnica de venopuncion para la extracción de la sangre fresca, donde se obtendrá por medio de centrifuga la separación de paquete sanguíneo y suero plasmático.
En esta práctica se debe de aplicar el tema de serológica, ya que ocuparemos los tificos H, O, y paratíficos A, B, Brucella Abortus y Proteus OX19.
Esta prueba es exclusivamente de aglutinación por lo que se debe observar a tras luz en forma macroscópica y en el microscopio, en el objetivo 10x de forma microscópica.
*Materiales
1.- Lamina de cristal para reacciones febriles.
2.- Tubo de ensaye tapón rojo
3.- Palitos de madera
4.- Torundas de algodón secas
5.- Torundas alcoholizadas
6.- Centrifuga
7.- Microscopio
8.- Reactivos febriclin
9.- Jeringa hipodérmica desechable
10.- Torniquete
11.- Masking tape
12.- Pipeta Pasteur
13.- Bulbo
*Marco Teórico
1.-La apertura de la práctica fue con la obtención de la toma de muestra, la cual costo un poco de trabajo puesto que es la primera vez que de obtiene sangre fresca obtenida por nosotros mismos.
2.-Ya obtenida la sangre fresca de los dos pacientes es introducida a los tubos de ensaye correspondientes, los cuales son etiquetados con los datos del paciente.
3.-La sangre se deja coagular y es introducida a la centrifuga para que a través de ella se obtenga la separación de paquete sanguíneo y suero plasmático.
4.- Ya separados el suero plasmático del paquete sanguíneo, el suero plasmático se pipetea a través de la pipeta Pasteur con bulbo y es punteado en la laminilla de cristal trasparente, así igual con el otro suero obtenido de la segunda toma de muestra.
5.- Ya punteada la laminilla de cristal, se le agrega una gota de febriclin tifico H, O y paratifico A, B, Brucella Abourtus y Proteus 0X19 de la siguiente manera.
6.- Ya realizado este procedimiento, con palillos de madera se mezcla el suero plasmático con los reactivos, claro esta, sin ser reutilizados los palillos.
7.- De igual manera se realiza una maniobra agitando la laminilla de cristal de un lado a otro y se observa macroscópicamente a tras luz.
8.- El resultado a tras luz fue homogéneo pero para tener un resultado mas seguro se realiza la observación microscópica
9.- La laminilla de cristal se coloca en la platina del microscopio y es observada en el objetivo 10x
10.- El resultado de esta prueba fue negativo, puesto que no se registro macroscópicamente y microscópicamente nada fuera de lo normal.
11.- La observación microscópica de igual modo que la macroscópica fue homogénea.
*Bitácora
-Equipo de bioseguridad: 3min
-Indicaciones: 11min
-Toma de muestra: 45min.
*Conclusión
Esta practica fue la mas importante para mi, puesto que aquí aparte de aprender a realizar el objetivo de la práctica que como ya sabemos, es aprender a realizar pruebas de aglutinación en suero sanguíneo, también dimos otro paso en la obtención de toma de muestra, ya que como lo mencione, nosotros mismos obtuvimos las muestras de sangre fresca, no fue nada fácil, pero con ayuda de los conocimientos adquiridos y brindados por los profesores de la especialidad fue del todo favorable.
También pusimos en practica muchos de nuestros otros conocimientos así como en las competencias en que participamos.
Borrador
Practica N° 8 “Prueba de aglutinación en suero de sangre”
- Examen de laboratorio “Reacciones febriles”
El alumno de laboratorio de análisis clínicos aprenderá a realizar una prueba de aglutinación en suero sanguíneo y sangre fresca, utilizando los instrumentos de laboratorio, equipo científico y reactivos para alcanzar su objetivo en la elaboración de un examen clínico denominado reacciones febriles; dando una oportunidad de poder investigar microorganismos bacteriológicos pertenecientes al grupo de las enterobacterias, donde encontraremos salmonella, brucilla y proteus.
*Materiales:
1.- Lamina de cristal para recciones febriles.
2.- Tubo de ensaye tapón rojo
3.- Palito de madera
4.- Torundas de algodón secas.
5.- Centrifuga
6.- Microscopio
7.- Reactivo febriclin
8.- Jeringa hipodérmica desechable
9.- Torniquete
10.- Torundas de algodón alcoholizadas
11.- Masking tape
12.- Pipeta Pasteur
13.- Bulbo
Nota: Utilizar técnica de veno punción para la extracción de sangre fresca, donde se obtendrá por medio de centrifuga la separación de paquete sanguíneo y suero plasmático.
En esta prueba se debe de aplicar el tema de serológica, ya que ocuparemos los tíficos H y O, paratíficos AB, brucilla abourtus y proteus 0X19
Esta prueba es exclusivamente de aglutinación. Por lo que se debe de observar a tras luz en forma macroscópica y en el microscopio, en el objetivo 10x de forma microscópica.
*Desarrollo
1.- Se utiliza la técnica de veno punción para la extracción de la sangre fresca de 2.5ml
2.- Una vez obtenida la sangre se deposita en el tubo con tapón rojo, pero antes, en el inicio de la extracción y vaciamiento del tubo se toma el tiempo de coagulación, el cual es de 1-2 min. Hasta 5 min. Y en algunas ocasiones hasta de 8min.
3.- Ya coagulada la sangre se retira el tapón del tubo y se depositan todos los tubos en la centrifuga para centrifugar a 1500 revoluciones por minuto, esto nos dará como resultado separación de paquetes.
4.- Una vez que se tengan los paquetes de sangre y plasma se requiere un tubo de sangre vacío para trasvasar el plasma exclusivamente, con el que se va a trabajar el punteo en lámina de cristal utilizando la pipeta Pasteur para puntear.
5.- Ya obtenido el punteo del plasma en la lamina de cristal se le agrega una gota de reactivo febriclin tendiendo el cuidado necesario del orden de los cerotitos “O-H-A-B-BRUCELLA Y PROTEUS”
6.- Ya obtenido este proceso en orden de serotipos prensamos pequeños pedazos de palillos de madera y mezclamos de forma individual cada uno de ellos, no se debe utilizar el mismo palillo antes utilizado.
7.- Ya estando mezclada la solución plasmática y reactivo de febriclin realizamos pequeños movimientos de rotación y traslación.
8.- Ya terminada esa mezcla observamos de forma macroscópica a tras luz, y si observamos la imagen punteada quiere decir que es una prueba positiva, si no es así, de le da el termino de homogéneo y será negativo.
9.- En la prueba que observamos el punteo, tanto macroscópicamente como microscópicamente, nos indica que tenemos una prueba de aglutinación en plasma y que debemos reportar de la siguiente manera.
O……negativo/positivo
H……negativo/positivo
A……negativo positivo
B……negativo/positivo
Brucella….negativo/positivo
Proteus…...negativo/positivo
Positivo para todas aquellas que se observe aglutinación y negativo para aquellas en las que no existe aglutinación
10.- En este examen de laboratorio, se lleva a cabo las 3 etapas: pre analítica, analítica y post analítica
Esta práctica tiene como objetivo que el alumno de laboratorio de análisis clínicos aprenda a realizar una prueba de aglutinación en suero sanguíneo, utilizando los instrumentos de laboratorio, equipo científico y reactivo para alcanzar su objetivo en la elaboración de un examen clínico denominado reacciones febriles, dando la oportunidad de investigar microorganismos bacteriológicos.
*Introducción
En esta practica se llevara a cabo la técnica de venopuncion para la extracción de la sangre fresca, donde se obtendrá por medio de centrifuga la separación de paquete sanguíneo y suero plasmático.
En esta práctica se debe de aplicar el tema de serológica, ya que ocuparemos los tificos H, O, y paratíficos A, B, Brucella Abortus y Proteus OX19.
Esta prueba es exclusivamente de aglutinación por lo que se debe observar a tras luz en forma macroscópica y en el microscopio, en el objetivo 10x de forma microscópica.
*Materiales
1.- Lamina de cristal para reacciones febriles.
2.- Tubo de ensaye tapón rojo
3.- Palitos de madera
4.- Torundas de algodón secas
5.- Torundas alcoholizadas
6.- Centrifuga
7.- Microscopio
8.- Reactivos febriclin
9.- Jeringa hipodérmica desechable
10.- Torniquete
11.- Masking tape
12.- Pipeta Pasteur
13.- Bulbo
*Marco Teórico
1.-La apertura de la práctica fue con la obtención de la toma de muestra, la cual costo un poco de trabajo puesto que es la primera vez que de obtiene sangre fresca obtenida por nosotros mismos.
2.-Ya obtenida la sangre fresca de los dos pacientes es introducida a los tubos de ensaye correspondientes, los cuales son etiquetados con los datos del paciente.
3.-La sangre se deja coagular y es introducida a la centrifuga para que a través de ella se obtenga la separación de paquete sanguíneo y suero plasmático.
4.- Ya separados el suero plasmático del paquete sanguíneo, el suero plasmático se pipetea a través de la pipeta Pasteur con bulbo y es punteado en la laminilla de cristal trasparente, así igual con el otro suero obtenido de la segunda toma de muestra.
5.- Ya punteada la laminilla de cristal, se le agrega una gota de febriclin tifico H, O y paratifico A, B, Brucella Abourtus y Proteus 0X19 de la siguiente manera.
6.- Ya realizado este procedimiento, con palillos de madera se mezcla el suero plasmático con los reactivos, claro esta, sin ser reutilizados los palillos.
7.- De igual manera se realiza una maniobra agitando la laminilla de cristal de un lado a otro y se observa macroscópicamente a tras luz.
8.- El resultado a tras luz fue homogéneo pero para tener un resultado mas seguro se realiza la observación microscópica
9.- La laminilla de cristal se coloca en la platina del microscopio y es observada en el objetivo 10x
10.- El resultado de esta prueba fue negativo, puesto que no se registro macroscópicamente y microscópicamente nada fuera de lo normal.
11.- La observación microscópica de igual modo que la macroscópica fue homogénea.
*Bitácora
-Equipo de bioseguridad: 3min
-Indicaciones: 11min
-Toma de muestra: 45min.
*Conclusión
Esta practica fue la mas importante para mi, puesto que aquí aparte de aprender a realizar el objetivo de la práctica que como ya sabemos, es aprender a realizar pruebas de aglutinación en suero sanguíneo, también dimos otro paso en la obtención de toma de muestra, ya que como lo mencione, nosotros mismos obtuvimos las muestras de sangre fresca, no fue nada fácil, pero con ayuda de los conocimientos adquiridos y brindados por los profesores de la especialidad fue del todo favorable.
También pusimos en practica muchos de nuestros otros conocimientos así como en las competencias en que participamos.
Borrador
Practica N° 8 “Prueba de aglutinación en suero de sangre”
- Examen de laboratorio “Reacciones febriles”
El alumno de laboratorio de análisis clínicos aprenderá a realizar una prueba de aglutinación en suero sanguíneo y sangre fresca, utilizando los instrumentos de laboratorio, equipo científico y reactivos para alcanzar su objetivo en la elaboración de un examen clínico denominado reacciones febriles; dando una oportunidad de poder investigar microorganismos bacteriológicos pertenecientes al grupo de las enterobacterias, donde encontraremos salmonella, brucilla y proteus.
*Materiales:
1.- Lamina de cristal para recciones febriles.
2.- Tubo de ensaye tapón rojo
3.- Palito de madera
4.- Torundas de algodón secas.
5.- Centrifuga
6.- Microscopio
7.- Reactivo febriclin
8.- Jeringa hipodérmica desechable
9.- Torniquete
10.- Torundas de algodón alcoholizadas
11.- Masking tape
12.- Pipeta Pasteur
13.- Bulbo
Nota: Utilizar técnica de veno punción para la extracción de sangre fresca, donde se obtendrá por medio de centrifuga la separación de paquete sanguíneo y suero plasmático.
En esta prueba se debe de aplicar el tema de serológica, ya que ocuparemos los tíficos H y O, paratíficos AB, brucilla abourtus y proteus 0X19
Esta prueba es exclusivamente de aglutinación. Por lo que se debe de observar a tras luz en forma macroscópica y en el microscopio, en el objetivo 10x de forma microscópica.
*Desarrollo
1.- Se utiliza la técnica de veno punción para la extracción de la sangre fresca de 2.5ml
2.- Una vez obtenida la sangre se deposita en el tubo con tapón rojo, pero antes, en el inicio de la extracción y vaciamiento del tubo se toma el tiempo de coagulación, el cual es de 1-2 min. Hasta 5 min. Y en algunas ocasiones hasta de 8min.
3.- Ya coagulada la sangre se retira el tapón del tubo y se depositan todos los tubos en la centrifuga para centrifugar a 1500 revoluciones por minuto, esto nos dará como resultado separación de paquetes.
4.- Una vez que se tengan los paquetes de sangre y plasma se requiere un tubo de sangre vacío para trasvasar el plasma exclusivamente, con el que se va a trabajar el punteo en lámina de cristal utilizando la pipeta Pasteur para puntear.
5.- Ya obtenido el punteo del plasma en la lamina de cristal se le agrega una gota de reactivo febriclin tendiendo el cuidado necesario del orden de los cerotitos “O-H-A-B-BRUCELLA Y PROTEUS”
6.- Ya obtenido este proceso en orden de serotipos prensamos pequeños pedazos de palillos de madera y mezclamos de forma individual cada uno de ellos, no se debe utilizar el mismo palillo antes utilizado.
7.- Ya estando mezclada la solución plasmática y reactivo de febriclin realizamos pequeños movimientos de rotación y traslación.
8.- Ya terminada esa mezcla observamos de forma macroscópica a tras luz, y si observamos la imagen punteada quiere decir que es una prueba positiva, si no es así, de le da el termino de homogéneo y será negativo.
9.- En la prueba que observamos el punteo, tanto macroscópicamente como microscópicamente, nos indica que tenemos una prueba de aglutinación en plasma y que debemos reportar de la siguiente manera.
O……negativo/positivo
H……negativo/positivo
A……negativo positivo
B……negativo/positivo
Brucella….negativo/positivo
Proteus…...negativo/positivo
Positivo para todas aquellas que se observe aglutinación y negativo para aquellas en las que no existe aglutinación
10.- En este examen de laboratorio, se lleva a cabo las 3 etapas: pre analítica, analítica y post analítica
PRACTICA 6 y 7. TINCION DE GRAM
Se debe realizar una tinción en el frotis para poder llegar ala observación microscópica de los organismos denominados bacterias los que observamos en forma de esferas, bastones y espirales cave mencionar en este elementó de observación no podríamos llegar a señalar microscópicamente las espirales
Materiales
Caja de COPRI mecheros
Porta objetos aceite
Torundas de algodón alcoholizadas
Papel secante
Microscopio
Desarrollo
Una vez teñida la laminilla con frotis se le aplica una gota de aceite de inmersión para poder observaren objetivo de 100x en este proceso de observación microscópica tenemos la facilidad de poder observar formas esféricas lo que nos deja observar las coloraciones de la tinción de gramos la presentación en esferas, que estamos observando bacterias denominadas cocos, donde veremos investigar sus características coloniales de importancia medica cuando observamos bastoncitos de bacilos. Donde encontraremos una gran cantidad investigaremos sus características coloniales y nombres de interés medico.
Objetivo
El objetivo de esta práctica fue aprender hacer la tinción de Gram. , y aprender a enfocar mejor en el microscopio. Ya que ya sabíamos enfocar pero esta práctica nos sirvió para que pudiéramos enfocar mejor. Otro de los objetivos es observar bien cada imagen que se vio en el microscopio.
Introducción
Esta práctica fue la elaboración de tinción de Gram., pasamos por cuatro botes con soluciones distintas el porta objetos en cada bote era un minuto y en cada cambio se tenia que lavar con agua corriente ya listo se tenia que esperar a k se secara para después enfocar.
Materiales
*microscopio
*6 cajas de petri
*porta objetos
*papel secante
*3 torundas de algodón secas
*aceite de inmersión
*2 mecheros
*papel para vestir mesa
*caja de COPRI
Desarrollo
Primero tomamos el cubre objetos para realizar los pasos que estaban en el pizarrón.
Después fuimos pasando por el porta objetos por 1 min. En cada solución y después de cada cambio de aceite se lavaba el cubre objetos con agua corriente después de todos los pasos se espero para que el cubre objetos se secara para después ponerle una gotita de aceite en el centro y hay poder ver en el microscopio las bacterias muy raras largas y otras cortas.
Conclusión
Mi conclusión fue que es que cada que pasemos el cubre objetos por cada respirante tenemos que enjuagarlo con agua y en esta practica sirvió de mucho.
Materiales
Caja de COPRI mecheros
Porta objetos aceite
Torundas de algodón alcoholizadas
Papel secante
Microscopio
Desarrollo
Una vez teñida la laminilla con frotis se le aplica una gota de aceite de inmersión para poder observaren objetivo de 100x en este proceso de observación microscópica tenemos la facilidad de poder observar formas esféricas lo que nos deja observar las coloraciones de la tinción de gramos la presentación en esferas, que estamos observando bacterias denominadas cocos, donde veremos investigar sus características coloniales de importancia medica cuando observamos bastoncitos de bacilos. Donde encontraremos una gran cantidad investigaremos sus características coloniales y nombres de interés medico.
Objetivo
El objetivo de esta práctica fue aprender hacer la tinción de Gram. , y aprender a enfocar mejor en el microscopio. Ya que ya sabíamos enfocar pero esta práctica nos sirvió para que pudiéramos enfocar mejor. Otro de los objetivos es observar bien cada imagen que se vio en el microscopio.
Introducción
Esta práctica fue la elaboración de tinción de Gram., pasamos por cuatro botes con soluciones distintas el porta objetos en cada bote era un minuto y en cada cambio se tenia que lavar con agua corriente ya listo se tenia que esperar a k se secara para después enfocar.
Materiales
*microscopio
*6 cajas de petri
*porta objetos
*papel secante
*3 torundas de algodón secas
*aceite de inmersión
*2 mecheros
*papel para vestir mesa
*caja de COPRI
Desarrollo
Primero tomamos el cubre objetos para realizar los pasos que estaban en el pizarrón.
Después fuimos pasando por el porta objetos por 1 min. En cada solución y después de cada cambio de aceite se lavaba el cubre objetos con agua corriente después de todos los pasos se espero para que el cubre objetos se secara para después ponerle una gotita de aceite en el centro y hay poder ver en el microscopio las bacterias muy raras largas y otras cortas.
Conclusión
Mi conclusión fue que es que cada que pasemos el cubre objetos por cada respirante tenemos que enjuagarlo con agua y en esta practica sirvió de mucho.
PRACTICA 5. FROTIS
Objetivo
Realizar un frotis de las colonias bacterianas que han crecido en los medios de cultivo, el cual deberá ser fino y delgado para poder realizar un proceso de tinción y posteriormente observarlo microscópicamente con aceite de inmersión en objetivo 100x.
Introducción
Solicitaremos los materiales necesarios para realizar la práctica, con nuestro equipo de bioseguridad ya colocado. Pediremos principalmente las cajas Petri con los medios de cultivo, tendremos el debido cuidado al utilizar los materiales y los colocaremos dentro de la zona de esterilización en medio de la mesa, y comenzaremos la práctica No 5 llamada “FROTIS”.
Índice
1.-Objetivo
2.-Introducción
3.- Marco Teórico
*Desarrollo
*Notas
*Dibujos
* Bitácora
*Observaciones personales
4.- Conclusión
5.- Fichas Bibliográficas
Marco Teórico
Materiales:
1.-Cajas Petri con medios de cultivo
2.-Asa Bacteriológica
3.-Vaso de precipitados con agua destilada con 25 ml
4.- 2 Mecheros de Bunsen
5.-Papel secante
6.- 8 portaobjetos
Desarrollo
Tomaremos las cajas Petri con los medios de cultivo y las abriremos, esterilizaremos las asas bacteriológicas con los mecheros de bunsen, tomaremos una gota de agua destilada con el asa bacteriológica y la colocaremos en el centro del portaobjetos, después toaremos una pequeña muestra de la bacteria que ha crecido en el medio de cultivo y la esparciremos con movimientos de izquierda a derecha, si el frotis queda muy grueso esterilizamos de nuevo el asa bacteriológica y le colocamos de nuevo una gota de agua destilada realizando el mismo procedimiento hasta que el frotis quede finamente delgado, que casi nos se vea más que a tras luz.
Una vez que el frotis ya quedo delgado vamos a fijarlo al portaobjetos es decir lo pasaremos por la flama del mechero sin dejarlo fijamente para evitar que las bacterias se derritan y cambien su morfología. Una vez fijado el frotis queda listo para el proceso de tinción Gram.
Tiempo Actividad
3 min. Colocar equipo de bioseguridad
5 min. Esterilizar las asas bacteriológicas
20 min Realizar frotis
3 min Fijar frotis
Observaciones
Fue un poco más difícil de lo que pensamos, pero aún así lo hicimos bien quedo el frotis delgado y fijado. Listo para la tinción Gram.
Conclusión
Fue la práctica que realizamos en menos tiempo y si nos fue suficiente, ya que terminamos justo a tiempo, si batallamos un poquito en adelgazar el frotis, pero todo resulto bien casi no se veía> A tras luz sí. Una vez listo el frotis y ya fijado los guardamos, los colocamos en papel secante y lo pegamos con tape, se las entregamos al profesor, al igual que los medios de cultivo, que se utilizaron en caso de necesitar hacer un nuevo frotis.
Ficha Bibliográfica
1.- Observaciones personales y grupales
2.- Apuntes de clase
3.- www.monografias.com
Borrador
Práctica No 5
Frotis“Elaboración de un frotis
El alumno debe realizar un frotis con el producto teñido en las cajas Petri, el cual debe ser fino y delgado para poder realizar un proceso de tinción.
Materiales:
1.- Cajas Petri con medios de cultivo
2.- asa bacteriológica
3.-vaso de precipitados con 25 ml de agua destilada
4.- Mecheros de bunsen
5.-Papel secante
6.- 8 portaobjetos
Desarrollo
Se toma un portaobjetos limpio para poder realizar en su superficie un frotis fresco con el material de la caja Petri “bacteriológico”.
Con el asa bacteriológica se va a realizar un barrido en el portaobjetos en su parte central, esterilizando primero el asa bacteriológica en la flama del mechero, dejándola hasta rojo vivo, una vez fijado el frotis queda listo para el proceso de tinción de Gram.
Realizar un frotis de las colonias bacterianas que han crecido en los medios de cultivo, el cual deberá ser fino y delgado para poder realizar un proceso de tinción y posteriormente observarlo microscópicamente con aceite de inmersión en objetivo 100x.
Introducción
Solicitaremos los materiales necesarios para realizar la práctica, con nuestro equipo de bioseguridad ya colocado. Pediremos principalmente las cajas Petri con los medios de cultivo, tendremos el debido cuidado al utilizar los materiales y los colocaremos dentro de la zona de esterilización en medio de la mesa, y comenzaremos la práctica No 5 llamada “FROTIS”.
Índice
1.-Objetivo
2.-Introducción
3.- Marco Teórico
*Desarrollo
*Notas
*Dibujos
* Bitácora
*Observaciones personales
4.- Conclusión
5.- Fichas Bibliográficas
Marco Teórico
Materiales:
1.-Cajas Petri con medios de cultivo
2.-Asa Bacteriológica
3.-Vaso de precipitados con agua destilada con 25 ml
4.- 2 Mecheros de Bunsen
5.-Papel secante
6.- 8 portaobjetos
Desarrollo
Tomaremos las cajas Petri con los medios de cultivo y las abriremos, esterilizaremos las asas bacteriológicas con los mecheros de bunsen, tomaremos una gota de agua destilada con el asa bacteriológica y la colocaremos en el centro del portaobjetos, después toaremos una pequeña muestra de la bacteria que ha crecido en el medio de cultivo y la esparciremos con movimientos de izquierda a derecha, si el frotis queda muy grueso esterilizamos de nuevo el asa bacteriológica y le colocamos de nuevo una gota de agua destilada realizando el mismo procedimiento hasta que el frotis quede finamente delgado, que casi nos se vea más que a tras luz.
Una vez que el frotis ya quedo delgado vamos a fijarlo al portaobjetos es decir lo pasaremos por la flama del mechero sin dejarlo fijamente para evitar que las bacterias se derritan y cambien su morfología. Una vez fijado el frotis queda listo para el proceso de tinción Gram.
Tiempo Actividad
3 min. Colocar equipo de bioseguridad
5 min. Esterilizar las asas bacteriológicas
20 min Realizar frotis
3 min Fijar frotis
Observaciones
Fue un poco más difícil de lo que pensamos, pero aún así lo hicimos bien quedo el frotis delgado y fijado. Listo para la tinción Gram.
Conclusión
Fue la práctica que realizamos en menos tiempo y si nos fue suficiente, ya que terminamos justo a tiempo, si batallamos un poquito en adelgazar el frotis, pero todo resulto bien casi no se veía> A tras luz sí. Una vez listo el frotis y ya fijado los guardamos, los colocamos en papel secante y lo pegamos con tape, se las entregamos al profesor, al igual que los medios de cultivo, que se utilizaron en caso de necesitar hacer un nuevo frotis.
Ficha Bibliográfica
1.- Observaciones personales y grupales
2.- Apuntes de clase
3.- www.monografias.com
Borrador
Práctica No 5
Frotis“Elaboración de un frotis
El alumno debe realizar un frotis con el producto teñido en las cajas Petri, el cual debe ser fino y delgado para poder realizar un proceso de tinción.
Materiales:
1.- Cajas Petri con medios de cultivo
2.- asa bacteriológica
3.-vaso de precipitados con 25 ml de agua destilada
4.- Mecheros de bunsen
5.-Papel secante
6.- 8 portaobjetos
Desarrollo
Se toma un portaobjetos limpio para poder realizar en su superficie un frotis fresco con el material de la caja Petri “bacteriológico”.
Con el asa bacteriológica se va a realizar un barrido en el portaobjetos en su parte central, esterilizando primero el asa bacteriológica en la flama del mechero, dejándola hasta rojo vivo, una vez fijado el frotis queda listo para el proceso de tinción de Gram.
PRACTICA 4. OBSERVACION MACROSCOPICA
OBJETIVO
Realizar una observación macroscópica de las colonias bacteriana que hayan creado en 72 hrs. dentro de los medios de cultivo anteriormente elaborados , utilizando el pie de rey o vernier y analizar los cambios que registre las cajas petri así como el color, el olor, crecimiento de las bacterias en los medios de cultivo dentro del campo de esterilización,. Siempre en medio de los dos mecheros de bunsen, en el centro de la mesa que ya esta debidamente vestida.
Introducción
Entramos debidamente organizados a laboratorio de química con nuestro equipo de bioseguridad ya puesto.
Empezaremos con la practica numero 4 que es la de observación macroscópicamente después de una incubación de 37ºc durante 72 hrs. .
Todo esto se debe de observar el crecimiento de las bacterias en las cajas de petri, que a su vez son los siguientes que se utilizaron so:
Eosina y azul de metileno, verde brillante, salmonella schigella, DX saburada, Mc Conkey y EMB., todo esto es para la observación de las bacterias que se pueda dan encontrar.
INDICE
1; OBJETIVO
2; INTRODUCCION
3; MARCO TEORICO
4; DESARROLLO, nota, bitácora dibujos
5; FICHA BIBLIOGRAFICA
MARCO TEORICO
MATERIAL:
2 mecheros de bunsen
Cajas de petri con medio de cultivo ya elaborado
Papel para cubrir la mesa
Pie de rey o vernier
DESARROLLO
llegamos puntualmente al laboratorio con neutro equipo de bioseguridad debidamente colocado, ponemos el papel para cubrir la mesa, solicitamos vale para pedir el material que se ocupara, después colocamos los mecheros y len el centro de la mesa y los prendemos para crear el campo de esterilización y poder colocar los medios de cultivo, una vez en la mesa los medios de cultivo los separamos y los abrimos para poder proceder la observación macroscópica, donde los estudiaremos detenidamente para observar el crecimiento délas colonias bacterianas, registrando el color el olor, las formas su apariencia entre otras cosas después registramos los datos en una tabla.
al terminar volvemos a cerrar las cajas de petri , se las entregamos al profesor junto con los apuntes , quitaremos el papel para cubrir la mesa, los mecheros ,cerramos la llave de gas, subiremos los bancos y nos retiraremos dando por terminado la practica N º 4.
BITACORA
ACTIVIDAD TIEMPO
Colocación del equipo de bioseguridad 3 minutos
Obtención dEL materiaL : 30 minutos
observaciones 9 minutos
Tiempo de la practica 52 minutos con 3 segundos
OBSERVACION MACROSCOPICA
HORA DE LA SALIDA: 8; 27AM
SALIDA: 8; 35AM
1/2 DE CULTIVO: eosina y azul de metileno
COLONIAS EN CRECIMIENTO: aparentemente no visibles pero con puntos dispersados
C/1: eosina y azul de metileno, siembra: muestra de orina, método de: kass
OBSERVACIONES: se volvió liquido dado una forma de M voluptuosa y con cambio de color de rojo violeta., dando poco crecimiento bacterias de puntos verdes 0.9 ml olor; orina
HORA DE LA SALIDA: 8:36 AM
SALIDA; 8:40AM
½ DE CULTIVO: Mc Conkey
COLONIAS EN CRECIMIENTO: se encuentran en la siembra y puntos dispersados y florerito dispersados
C/2; Mc Conkey siembra: estría por agotamiento, muestra: interdental.
OBSERVACIONES: crecimiento de colonias, puntos color morados y al final de la siembra los puntos se ven mas grandes y juntos y las colonias mas grandes miden 2cm y 1.8cm olor: fierro
HORA DE ENTRADA: 8:42
SALIDA: 8:47
½ DE CULTIVO: EMB
COLONIAS EN CRECIMIENTO: se observan puntos dispersados en forma de pelusa
C/3: EMB siembra por agotamiento siembra: de frijol
OBSERVACIONES: se observan puntos morados con bastante crecimiento bacteriológico donde una vista como si fuese morado mide 7mm
HORA DE ENTRADA: 8:50
SALIDA: 8:53
½ DE CULTIVO: Mc Conkey
COLONIAS EN CRECIMIENTO: manchas y puntos grises
C/4: Mc Conkey siembra masiva cuadriculada, muestra de: frijol
OBSERVACIONES: aparecieron diversas manchas de diferentes tamaños color: morado grasoso 1mm
HORA DE ENTRADA: 8:53
LADIDA: 8:56
½ CULTIVO: verde brillante
COLONIAS EN CRECIMIENTO: manchas verdosas horizontales
C/5: verde brillante, siembra dispersión muestra de verdura
OBSERVACION: crecimiento de la bacteria en forma horizontal con un color verdoso amarillentos y bacterias de diferente tamaño
HORA DE ENTRADA: 8:56
SALIDA: 8:59
½ DE CULTIVO: DX saborada
COLONIAS EN CRECIMINETO: puntos blancos
C/6: DX por agotamiento muestra: interdigital
OBSERVACIONES: muchos puntos blancos alrededor y en el centro un color oscuro y de diferentes tamaños, olor: a queso Cotija
HORA DE ENTRADA: 9:00
SALIDA: 9:01
½ DE CULTIVO: salmonella shigella
COLONIAS EN CRECIMIENTO: ninguna
C/7: siembra cuadriculada muestra: plasma
OBSERVACIONES: no se registro nada, solo cambio el color a durazno
HORA DE ENTRADA: 9:01
SALIDA: 9:03
½ DE CULTIVO: eusina y azul de metileno
COLONIAS EN CRECIMIENTO: contaminado
OBSERVACIONES: fue contaminada y registra un olor extremadamente fuete mide 6mm
COMPETENCIAS
Destreza manual y de observación, se utilizoolfato, vista y los distintos sentidos, excepto el gusto.
Se utilizo suma resta y división y la utilización de pie de rey.
No se realizo observación de 24 hrs. porque se atravesó el fin de semana
CONCLUSIÓN
La observación fue satisfactoria, no en todas las siembras en medios de cultivos presenta el crecimiento de bacterias, el profesor nos explico que se debe a dos causas
a) el medio esta mal elaborado
b) la persona ala que se le realizo la toma de muestra esta sana
Esperemos que la segunda opción sea, en las demás cajas petri si hubo crecimiento de las bacterias en la que mas se notaba era en la muestra de frijol .
Fue una práctica fácil para los que estudiaron.
Ficha bibliográfica
1; observaciones personales
2: apuntes de clase
Borrador
OBSERVACIÓN MACROSCÓPICA
El alumno realizara observaciones macroscópicamente de las cajas de petri. Anteriormente sembradas en las que se presento el desarrollo o crecimiento de las colonias bacterianas.
Material:
1: cajas de petri con medio de cultivo
2; asa bacteriológica
3: dos mecheros de bunsen
4: vaso de precipitado de 25 ml
5: pie de rey o vernier
6: 3 torundas de algodón secas
7: 3 torundas de algodón alcoholizadas
DESARROLLO (macroscópicamente)
1. las cajas de petri ya sembradas son depositadas en le campo esterilizado, que se realiza con los dos mecheros de bunsen en la parte media de la mesa.
2. una vez teniendo el campo de esterilización se observa los crecimientos de las cajas de petri se registra lo observado, se abre la caja de petri se registra el olor que le sale, el color que presenta y se registra en gráficos y fotografías
Realizar una observación macroscópica de las colonias bacteriana que hayan creado en 72 hrs. dentro de los medios de cultivo anteriormente elaborados , utilizando el pie de rey o vernier y analizar los cambios que registre las cajas petri así como el color, el olor, crecimiento de las bacterias en los medios de cultivo dentro del campo de esterilización,. Siempre en medio de los dos mecheros de bunsen, en el centro de la mesa que ya esta debidamente vestida.
Introducción
Entramos debidamente organizados a laboratorio de química con nuestro equipo de bioseguridad ya puesto.
Empezaremos con la practica numero 4 que es la de observación macroscópicamente después de una incubación de 37ºc durante 72 hrs. .
Todo esto se debe de observar el crecimiento de las bacterias en las cajas de petri, que a su vez son los siguientes que se utilizaron so:
Eosina y azul de metileno, verde brillante, salmonella schigella, DX saburada, Mc Conkey y EMB., todo esto es para la observación de las bacterias que se pueda dan encontrar.
INDICE
1; OBJETIVO
2; INTRODUCCION
3; MARCO TEORICO
4; DESARROLLO, nota, bitácora dibujos
5; FICHA BIBLIOGRAFICA
MARCO TEORICO
MATERIAL:
2 mecheros de bunsen
Cajas de petri con medio de cultivo ya elaborado
Papel para cubrir la mesa
Pie de rey o vernier
DESARROLLO
llegamos puntualmente al laboratorio con neutro equipo de bioseguridad debidamente colocado, ponemos el papel para cubrir la mesa, solicitamos vale para pedir el material que se ocupara, después colocamos los mecheros y len el centro de la mesa y los prendemos para crear el campo de esterilización y poder colocar los medios de cultivo, una vez en la mesa los medios de cultivo los separamos y los abrimos para poder proceder la observación macroscópica, donde los estudiaremos detenidamente para observar el crecimiento délas colonias bacterianas, registrando el color el olor, las formas su apariencia entre otras cosas después registramos los datos en una tabla.
al terminar volvemos a cerrar las cajas de petri , se las entregamos al profesor junto con los apuntes , quitaremos el papel para cubrir la mesa, los mecheros ,cerramos la llave de gas, subiremos los bancos y nos retiraremos dando por terminado la practica N º 4.
BITACORA
ACTIVIDAD TIEMPO
Colocación del equipo de bioseguridad 3 minutos
Obtención dEL materiaL : 30 minutos
observaciones 9 minutos
Tiempo de la practica 52 minutos con 3 segundos
OBSERVACION MACROSCOPICA
HORA DE LA SALIDA: 8; 27AM
SALIDA: 8; 35AM
1/2 DE CULTIVO: eosina y azul de metileno
COLONIAS EN CRECIMIENTO: aparentemente no visibles pero con puntos dispersados
C/1: eosina y azul de metileno, siembra: muestra de orina, método de: kass
OBSERVACIONES: se volvió liquido dado una forma de M voluptuosa y con cambio de color de rojo violeta., dando poco crecimiento bacterias de puntos verdes 0.9 ml olor; orina
HORA DE LA SALIDA: 8:36 AM
SALIDA; 8:40AM
½ DE CULTIVO: Mc Conkey
COLONIAS EN CRECIMIENTO: se encuentran en la siembra y puntos dispersados y florerito dispersados
C/2; Mc Conkey siembra: estría por agotamiento, muestra: interdental.
OBSERVACIONES: crecimiento de colonias, puntos color morados y al final de la siembra los puntos se ven mas grandes y juntos y las colonias mas grandes miden 2cm y 1.8cm olor: fierro
HORA DE ENTRADA: 8:42
SALIDA: 8:47
½ DE CULTIVO: EMB
COLONIAS EN CRECIMIENTO: se observan puntos dispersados en forma de pelusa
C/3: EMB siembra por agotamiento siembra: de frijol
OBSERVACIONES: se observan puntos morados con bastante crecimiento bacteriológico donde una vista como si fuese morado mide 7mm
HORA DE ENTRADA: 8:50
SALIDA: 8:53
½ DE CULTIVO: Mc Conkey
COLONIAS EN CRECIMIENTO: manchas y puntos grises
C/4: Mc Conkey siembra masiva cuadriculada, muestra de: frijol
OBSERVACIONES: aparecieron diversas manchas de diferentes tamaños color: morado grasoso 1mm
HORA DE ENTRADA: 8:53
LADIDA: 8:56
½ CULTIVO: verde brillante
COLONIAS EN CRECIMIENTO: manchas verdosas horizontales
C/5: verde brillante, siembra dispersión muestra de verdura
OBSERVACION: crecimiento de la bacteria en forma horizontal con un color verdoso amarillentos y bacterias de diferente tamaño
HORA DE ENTRADA: 8:56
SALIDA: 8:59
½ DE CULTIVO: DX saborada
COLONIAS EN CRECIMINETO: puntos blancos
C/6: DX por agotamiento muestra: interdigital
OBSERVACIONES: muchos puntos blancos alrededor y en el centro un color oscuro y de diferentes tamaños, olor: a queso Cotija
HORA DE ENTRADA: 9:00
SALIDA: 9:01
½ DE CULTIVO: salmonella shigella
COLONIAS EN CRECIMIENTO: ninguna
C/7: siembra cuadriculada muestra: plasma
OBSERVACIONES: no se registro nada, solo cambio el color a durazno
HORA DE ENTRADA: 9:01
SALIDA: 9:03
½ DE CULTIVO: eusina y azul de metileno
COLONIAS EN CRECIMIENTO: contaminado
OBSERVACIONES: fue contaminada y registra un olor extremadamente fuete mide 6mm
COMPETENCIAS
Destreza manual y de observación, se utilizoolfato, vista y los distintos sentidos, excepto el gusto.
Se utilizo suma resta y división y la utilización de pie de rey.
No se realizo observación de 24 hrs. porque se atravesó el fin de semana
CONCLUSIÓN
La observación fue satisfactoria, no en todas las siembras en medios de cultivos presenta el crecimiento de bacterias, el profesor nos explico que se debe a dos causas
a) el medio esta mal elaborado
b) la persona ala que se le realizo la toma de muestra esta sana
Esperemos que la segunda opción sea, en las demás cajas petri si hubo crecimiento de las bacterias en la que mas se notaba era en la muestra de frijol .
Fue una práctica fácil para los que estudiaron.
Ficha bibliográfica
1; observaciones personales
2: apuntes de clase
Borrador
OBSERVACIÓN MACROSCÓPICA
El alumno realizara observaciones macroscópicamente de las cajas de petri. Anteriormente sembradas en las que se presento el desarrollo o crecimiento de las colonias bacterianas.
Material:
1: cajas de petri con medio de cultivo
2; asa bacteriológica
3: dos mecheros de bunsen
4: vaso de precipitado de 25 ml
5: pie de rey o vernier
6: 3 torundas de algodón secas
7: 3 torundas de algodón alcoholizadas
DESARROLLO (macroscópicamente)
1. las cajas de petri ya sembradas son depositadas en le campo esterilizado, que se realiza con los dos mecheros de bunsen en la parte media de la mesa.
2. una vez teniendo el campo de esterilización se observa los crecimientos de las cajas de petri se registra lo observado, se abre la caja de petri se registra el olor que le sale, el color que presenta y se registra en gráficos y fotografías
PRACTICA 3. SIEMBRAS EN CAJAS PETRI CON MEDIO DE CULTIVO
Objetivo
Esta práctica se trata de siembra con cajas de petri en formas de petri, el objetivo de la práctica es sembrar en las cajas petri las muestras de desechos de cada una de las personas del equipo trajo son: muestras interdentales, raspado de pie, orina, agua fresca, agua de chile, y muestra desangre.
Todo esto es para si en 24-48-72 horas el producto y para observar en cada caja petri la relación que tomo el microscopio.
Material:
Asa bacteriológica
Cajas de petri
Muestras de desecho;(saliva muestra interdental, orina, agua fresca, raspado de pie, muestra desangre)
Vaso precipitado 25 ml
Papel para vestir mesa
Papel secante
Torundas de algodón alcoholizadas
Tape
Centrifuga
2 mecheros
Varilla de cristal
Tubo de ensaye de tapón rojo
Tubo de ensaye
Torniquete
Aguja de 5 ml
Sangre fresca
INTRODUCCION
En esta práctica de siembra de estrías es muy importante porque con ella estamos cultivando las muestras de desecho.
Todo esto es el seguimiento de las demás practicas , con la toma de muestra fue lo mas importante por que se separo el paquete sanguíneo para sembrar el plasma en un medio de cultivo pero con el agar adecuado por que si no esta en el de salmonella scherichia no funcionara por que es el de dispersión.
Los demás medios de desecho se siembra en los demás agares en las determinadas siembras.
DESARROLLO
1-en primer lugar entramos a laboratorio con el equipo de bioseguridad adecuadamente
2-Pedimos el Material que ocupamos en la practica de siembra
3_Se prenden adecuadamente los mecheros de bunsen pero primero se prenden las llaves de gas
4_A continuación se empieza a esterilizar el material de laboratorio para que no se contamine las siembras
5_El profesor entrega las cajas de petri al encargado de la mesa para empezara sembrar
6_Se hace la toma de muestra a la persona que se le estriará la sangre requerida pero antes de todo se tienen que realizar las sig indicaciones:
1-Se limpia el brazo con una torunda de algodón de arriba hacia abajo
2-Se pone el torniquete
3-Se empieza a sentir la veno punción
4-Se empieza a sacar la toma de sangre
5-Se pasa la sangre al tubo de color rojo
7_Se prende la centrifuga para la orina y de la sangre para la reparación del paquete sanguíneo 1500 rev x min. Por 5 min.
8_Se empieza a preparar las siembras en las cajas de petri
9_Se empiezan a etiquetar cada caja de petri con el nombre del medio de cultivo nombre del paciente grupo.
10_se entregan las cajas de petri al encargado de la mesa para que se los entregue al profesor.
BITACORA
HORA PROSEDENTE
10;00 Entrada de laboratorio
10;02 Colocarse el equipo de bioseguridad
5 MIN Esterilización del material
3 MIN Obtención de muestra sanguínea
2 MIN coagulación
5 MIN centrifuga
10 MIN Muestra interdigital
25 MIN Sembrar cajas
CONCLUSIÓN
Con esta práctica aprendimos muchas cosas desde que empezamos a ponernos el equipo de bioseguridad hasta la practica de siembra con las cajas petri.
Cada uno del equipo realizo una muestra de las cajas de petri ., con todos nosotros esto es muy importante por que estamos utilizando aparatos nuevos como la centrifuga esto espero y este muy bien .
Jamás hay que decepcionar a las personas que confían en nosotros.
Borrador
MATERIALES:
° Cajas petri con medio de cultivo y elaborado
° Muestras de desecho (saliva, dientes, raspado de pie, orina, agua fresca, muestra de sangre)
° Asa bacteriológica
° Mecheros de bunsen
° Vaso de precipitado con 25 ml de agua destilada
° Papel para vestir mesa
° Papel secante
° Torundas de algodón
° Tape
DESARROLLO:
1- Se realiza la toma de muestra de desecho para sembrarla en forma de estría en la caja petri de la siguiente manera, con el asa bacteriológica tomamos una pequeña muestra de desechos y sembramos.
2- El asa bacteriológica se pasa por el mechero para esterilizarla y hacer el mismo proceso con otra muestra.
3- Una vez ya sembradas se cierran, se etiquetan aplicando los datos de la muestra y el tipo de estría sembrada.
4- Es importante que la siembra de la caja petri y la varilla de cristal al cual se da el nombre de siembras por dispersión.
5- Ya una vez etiquetadas se entregan al encargado
Esta práctica se trata de siembra con cajas de petri en formas de petri, el objetivo de la práctica es sembrar en las cajas petri las muestras de desechos de cada una de las personas del equipo trajo son: muestras interdentales, raspado de pie, orina, agua fresca, agua de chile, y muestra desangre.
Todo esto es para si en 24-48-72 horas el producto y para observar en cada caja petri la relación que tomo el microscopio.
Material:
Asa bacteriológica
Cajas de petri
Muestras de desecho;(saliva muestra interdental, orina, agua fresca, raspado de pie, muestra desangre)
Vaso precipitado 25 ml
Papel para vestir mesa
Papel secante
Torundas de algodón alcoholizadas
Tape
Centrifuga
2 mecheros
Varilla de cristal
Tubo de ensaye de tapón rojo
Tubo de ensaye
Torniquete
Aguja de 5 ml
Sangre fresca
INTRODUCCION
En esta práctica de siembra de estrías es muy importante porque con ella estamos cultivando las muestras de desecho.
Todo esto es el seguimiento de las demás practicas , con la toma de muestra fue lo mas importante por que se separo el paquete sanguíneo para sembrar el plasma en un medio de cultivo pero con el agar adecuado por que si no esta en el de salmonella scherichia no funcionara por que es el de dispersión.
Los demás medios de desecho se siembra en los demás agares en las determinadas siembras.
DESARROLLO
1-en primer lugar entramos a laboratorio con el equipo de bioseguridad adecuadamente
2-Pedimos el Material que ocupamos en la practica de siembra
3_Se prenden adecuadamente los mecheros de bunsen pero primero se prenden las llaves de gas
4_A continuación se empieza a esterilizar el material de laboratorio para que no se contamine las siembras
5_El profesor entrega las cajas de petri al encargado de la mesa para empezara sembrar
6_Se hace la toma de muestra a la persona que se le estriará la sangre requerida pero antes de todo se tienen que realizar las sig indicaciones:
1-Se limpia el brazo con una torunda de algodón de arriba hacia abajo
2-Se pone el torniquete
3-Se empieza a sentir la veno punción
4-Se empieza a sacar la toma de sangre
5-Se pasa la sangre al tubo de color rojo
7_Se prende la centrifuga para la orina y de la sangre para la reparación del paquete sanguíneo 1500 rev x min. Por 5 min.
8_Se empieza a preparar las siembras en las cajas de petri
9_Se empiezan a etiquetar cada caja de petri con el nombre del medio de cultivo nombre del paciente grupo.
10_se entregan las cajas de petri al encargado de la mesa para que se los entregue al profesor.
BITACORA
HORA PROSEDENTE
10;00 Entrada de laboratorio
10;02 Colocarse el equipo de bioseguridad
5 MIN Esterilización del material
3 MIN Obtención de muestra sanguínea
2 MIN coagulación
5 MIN centrifuga
10 MIN Muestra interdigital
25 MIN Sembrar cajas
CONCLUSIÓN
Con esta práctica aprendimos muchas cosas desde que empezamos a ponernos el equipo de bioseguridad hasta la practica de siembra con las cajas petri.
Cada uno del equipo realizo una muestra de las cajas de petri ., con todos nosotros esto es muy importante por que estamos utilizando aparatos nuevos como la centrifuga esto espero y este muy bien .
Jamás hay que decepcionar a las personas que confían en nosotros.
Borrador
MATERIALES:
° Cajas petri con medio de cultivo y elaborado
° Muestras de desecho (saliva, dientes, raspado de pie, orina, agua fresca, muestra de sangre)
° Asa bacteriológica
° Mecheros de bunsen
° Vaso de precipitado con 25 ml de agua destilada
° Papel para vestir mesa
° Papel secante
° Torundas de algodón
° Tape
DESARROLLO:
1- Se realiza la toma de muestra de desecho para sembrarla en forma de estría en la caja petri de la siguiente manera, con el asa bacteriológica tomamos una pequeña muestra de desechos y sembramos.
2- El asa bacteriológica se pasa por el mechero para esterilizarla y hacer el mismo proceso con otra muestra.
3- Una vez ya sembradas se cierran, se etiquetan aplicando los datos de la muestra y el tipo de estría sembrada.
4- Es importante que la siembra de la caja petri y la varilla de cristal al cual se da el nombre de siembras por dispersión.
5- Ya una vez etiquetadas se entregan al encargado
PRACTICA 1. ELABORACION DE MEDIO DE CULTIVO Y TECNICA DE ESTERILIZACION
INTRODUCCION:
Esta práctica se realiza con el fin de que el alumno aprenda y practique sobre la preparación de los medios de cultivo, con los diferentes agares, n este caso se utilizo el Salmonella Shigella, y pues este es el primer paso para analizar las muestras del cuerpo. El siguiente paso es el proceso de siembras.
OBJETIVO:
Esta práctica tiene como principal objetivo, que nos adentremos a la preparación y tratamiento de medios de cultivo así como también que nos podamos familiarizar con ellos para observar l crecimiento de bacterias.
MATERIALES:
1. Vaso de pp. 50 ml
2. Vaso de pp. 250 ml
3. Matraz Erlenmeyer de 250 Ml
4. Varilla de cristal como agitador
5. Vidrio de reloj
6. Cajas petri (5-7)
7. Espátula
8. Balanza granataria
9. Cinta masking tape
10. Embudo de cristal
11. Torundas de algodón
12. Papel secante
13. Medio de cultivo en polvo 450 gr.
14. Agua destilada 114 ml
MEDIO DE CULTIVO
BD BIOXON
AGAR
Salmonella y Shigella
1. Esterilización del material
2. Preparación del medio de cultivo
3. Se pesa el vidrio de reloj. (24.5)
4. Vidrio con agar (31.34 gr.)
5. Agar (6.84 gr.)
6. En cada caja petri se utilizaran 19 ml de solución
7. Se utilizaran 6 cajas petri
8. Se multiplica 6 x 19 gr. para realizar regla de 3
9. Se realiza regla de 3
60gr--------1000mL
X gr.-----------114mL
_________________
6.84gr
10. se prepara medio de cultivo
11. se agita con varilla de cristal para deshacer grumos.
12. se deja hervir 57 seg.
13. se deja enfriar
14. al enfriar se tapa con torundas de algodón, selladas con masking tape donde se anotaran los datos debidos.
15. se introduce el medio de cultivo con mucho cuidado a la autoclave por 30 minutos.
½ cultivo tiempo mesa Cajas petri H20 Polvo diluido Tiempo,aut..
diluido
Agar dextrosa
saborada --------- M-2 9 171 mL 11.11 gr …
Agar verde
brillante --------- M-3 9 171 mL 9.9 gr …
Agar salmonella
y shigella --------- M-4 6 114 mL 6.84 gr
Agar mc
conkey --------- M-5 8 160 mL 8 gr …
Agar con eosina
y azul de
metileno --------- M-6 9 171 mL 6.15 gr …
ESTERILIZACION EN EL AUTOCLAVE
Una ves etiquetadas las cajas se entregan al encargado de la mesa para que introduzca los medios en la autoclave, pero es importante que se sepa muy bien sobre el uso del autoclave ya que su uso inadecuado puede ser peligroso ya que se manejen muy altas temperaturas. Los medios de cultivo duraron 20 min. en la autoclave para subir a 15 lbs. y 30 min. en la esterilización.
BITACORA:
• Equipo de bioseguridad…………………5 min
• Forrado de mesa……………………………2 min
• Obtención del material………………….2min
• Esterilización del material………………3min
• Peso de vidrio de reloj………………….3min
• Regla de tres…………………………………1min
• Vaciado de agua y agar al matraz..2min
• Agitar medio de cultivo………………..3min
• Hervir el medio de cultivo…………….57seg
• Esterilización en el autoclave……….30min
• Vaciado a cajas petri……………………..7min
• Enfriamiento de medio de cultivo…10min
Borrador
PRACTICA No. 1 MEDIOS DE CULTIVO
En esta práctica que se va a realizar se toman en cuenta las tres etapas que se refieren a pre analítica, analítica y post analítica, las cuales se deben de compaginar con la práctica secuencial.
-INSTRUCCIONES:
En el laboratorio de análisis clínicos, debe estar puntual con su equipo de bioseguridad en el laboratorio, solicitar con su vale de material para que se habiliten todos los materiales a utilizar en la práctica de medios de cultivo.
• Una vez estando dentro del laboratorio los integrantes de las mesas a trabajar deberán habilitar el equipo de esterilización “autoclave”, el cual se debe cargar con agua destilada (estudiar técnica de esterilización).
• Vestir mesa de laboratorio con papel blanco.
• Habilitar línea de gas LP, cualquiera de sus integrantes debe abrir la válvula principal para el mantenimiento de la línea, verificarlo que las válvulas principales de cada mesa estén abiertas, las cuales se encuentran por debajo de la misma.
-DESARROLLO:
1. Para realizar un medio de cultivo requerimos los siguientes materiales de cristalería, de apoyo, científicos, etc.
-MATERIALES:
Matraz erlenmeyer de 250 ml
Vaso de pp. de 50 ml
Vaso de pp. de 250 ml
Varilla de cristal como agitador
Vidrio de reloj
Cajas petri (5-7 cajas)
Espátula
Balanza granataria
Cinta masking tape
Embudo de cristal
Torundas de algodón
Papel secante
Medio de cultivo en polvo, 450 gr
Agua destilada (?)
-PRACTICA:
Re hidratamos de acuerdo a las indicaciones que están presentes en la etiqueta del medio de cultivo, la cantidad necesaria de polvo reactivo, para la elaboración de 5- 7 cajas petri, en las que se debe de usar también agua destilada en volumen.
Para poder re hidratar el polvo reactivo en medio de cultivo necesitamos manejar una regla de 3.
Pesamos el medio de cultivo en polvo que vayamos a necesitar utilizando el vidrio de reloj.
Una vez pesado l polvo se mezclara con el agua solicitada para 5 cajas petri.
Para poder mezclar adecuadamente utilizaremos el matraz erlenmeyer para la mezcla o en su caso dado para el vaso de pp., agitando con la varilla de cristal para que no queden grumos. Una vez terminado este proceso de agitación y mezcla, dejamos reposar el tiempo que nos marque la etiqueta de medio de cultivo.
En este espacio de tiempo, todo el quipo consensa su nota de desarrollo, la cual lleva gráficos, dibujos, fotos, pequeños videos y así le damos tiempo al proceso de elaboración.
Una vez reposado se tienen ya listos los mecheros de bunsen, para poder realiza el proceso de ebullición, al cual se le dará un minuto de tiempo desde que este empieza a iniciar, se realiza un pequeño giro en muñequeo, por encima de la flama azul del mechero, siendo muy cuidadosos en que el producto no se derrame del equipo donde se contiene, y q que puede ocasionar quemaduras hasta de segundo grado.
Se muñequea se observa el hervor, se retira cuidadosamente una y otra vez, tomando el tiempo, hasta que se cumple l minuto.
Una vez terminada esta acción se observa el hervor, se retira cuidadosamente un y otra ves, tomando el tiempo, hasta que se cumpla el minuto.
Una vez terminada esta acción se observa, registra y se deposita en la mesa, se deja enfriar.
Ya estando frio el medio de cultivo liquido, tamponamos con algodón, sellando con cinta masking tape, asegurando bien la boquilla del matraz, etiquetamos con el numero de mesa además la hora y la fecha.
Los encargados del equipo de esterilización, solicitaran a las mesas los medios de cultivo para ponerlos en el auto clave y esterilizarlos, donde los encargados cerraran el equipo verificando que no exista riesgo se deben utilizar guantes.
Una ves terminado el proceso de esterilización, se retira el medio de cultivo del autoclave, se deposita en medio de los dos mecheros, los cuales están encendidos, formando un campo de esterilización por radiación.
LLENADO DE CAJAS PETRI:
Deben estar dentro del campo de esterilización de la mesa, no fuera de el, para realizar el llenado con medio de cultivo y este no se contamina.
Con el vaso de pp de 50 ml realizamos la actividad de vaciado peor antes esterilizaremos la boquilla del vasito en la llave de gas, pasándolo una y otra vez una vez que se realizo la acción vaciaremos la cantidad necesaria para el llenado de la misma.
Ya baseado el material en la caja petri, se deja cernir tapada, no en su totalidad, para que no exista vapor de agua.
Ya estando solidificado el medio de cultivo, se tapa, se estiva y se asegura con masking tape, para etiquetar con los datos ya mencionados.
Si el medio de cultivo se contamina en 24, 48 y 72 horas, se vuelve a realizar la práctica pero sancionados.
PRACTICA 2. TECNICA DE ESTERILIZACION.
Es una herramienta que se ocupa para esterilizar materiales de laboratorio, reactivos o medios de cultivo y algunos otros elementos que se requieran esterilizar. La estructura de la autoclave es la base de material acerado e inoxidable y consta de los sig. Elementos:
1. Tapa de acero inoxidable con válvula de escape en su parte superior de la tapa y un manómetro con forma de reloj. El cual nos da un registro en libras y en grados centígrados y en la parte interna pende una manguerita corrugada que nos da la posibilidad de poder dejar salir el vapor que se encuentra en el interior de la autoclave.
2. La olla en su interior contiene un contenedor de aluminio con dos asas y una pequeña parrilla van a esterilizar en su parte interna tiene como sostén una parrilla de alambre que nos da la facilidad de contener la olla y que no rose con la resistencia que da la energía al equipo en le fondo se encuentra una resistencia que opera por medio de corriente alterna (amperes). La parte exterior de la autoclave se encuentra en un dispositivo de encendido una perilla de baja y alta temperatura y foco de advertencia luminoso color rojo. La parte superior de la autoclave cuenta con unos grilletes que están a base de roscas y que son la medida de seguridad al cerrar la tapa de la autoclave y debe manejarse en forma de cruz. Se va a operar en forma de cruz asegurándolos de tal manera que con ello podemos evitar un accidente. La autoclave se debe manejar en su interior con agua destilada la cual se debe medir para registrar el volumen del líquido utilizado, el que debe ir al ras de la parrilla.
3. El proceso de esterilización de este equipo se lleva en ángulo plano “Tiempo” se ocupa sistema métrico decimal, volumen y masa además sistema anglosajón que es en libras y sistema de temperaturas también vamos a hacer conversiones de grados Celsius, kelvin y Fahrenheit. Este equipo alcanza una presión de 15 libras y una temperatura de 120oC.
4. El proceso de esterilización debe de ser por tiempos, inmediatamente después de entrar al laboratorio se deben de organizar en cada una de sus practicas y preparar el rol de equipo de esterilización por calor húmedo. Iniciando la clase de laboratorio en práctica se debe encender, habilitar con agua destilada el autoclave donde se ocupan 30 min de tiempo hasta que eleve su temperatura a punto de ebullición.
5. Purgar equipo: Una vez que el equipo de autoclave esta cerrado con seguridad se deje elevar la presión y que esta llega hasta 5 libras y posteriormente se empezará a dejar salir presión a base de vapor manipulando con un guante de seguridad para una temperatura la válvula de escape y asegurarse que vuelva a quedar en 0 libras quedando así de esta manera purgado el equipo. Una vez purgado el equipo se deja subir la aguja del manómetro hasta 15 libras y se registra el tiempo de elevación de esta temperatura ya estando las 15 libras se empieza a registrar el tiempo de 30 minutos, tiempo que nos da la esterilización de los productos. La presión de 15 libras que nos da 120oC si se descuida puede ocasionar accidentes severos. EQUIPO DE ESTERILIZACION DE CALOR SECO El equipo es para realizar trabajos inmediatos en cristalería, metales, todo tipo de esterilización pero ordenada para no tener errores en la actividad. Se opera con corriente alterna (amperes), 110 volteos y alcanza temperaturas de hasta 510oC.
Esta práctica se realiza con el fin de que el alumno aprenda y practique sobre la preparación de los medios de cultivo, con los diferentes agares, n este caso se utilizo el Salmonella Shigella, y pues este es el primer paso para analizar las muestras del cuerpo. El siguiente paso es el proceso de siembras.
OBJETIVO:
Esta práctica tiene como principal objetivo, que nos adentremos a la preparación y tratamiento de medios de cultivo así como también que nos podamos familiarizar con ellos para observar l crecimiento de bacterias.
MATERIALES:
1. Vaso de pp. 50 ml
2. Vaso de pp. 250 ml
3. Matraz Erlenmeyer de 250 Ml
4. Varilla de cristal como agitador
5. Vidrio de reloj
6. Cajas petri (5-7)
7. Espátula
8. Balanza granataria
9. Cinta masking tape
10. Embudo de cristal
11. Torundas de algodón
12. Papel secante
13. Medio de cultivo en polvo 450 gr.
14. Agua destilada 114 ml
MEDIO DE CULTIVO
BD BIOXON
AGAR
Salmonella y Shigella
1. Esterilización del material
2. Preparación del medio de cultivo
3. Se pesa el vidrio de reloj. (24.5)
4. Vidrio con agar (31.34 gr.)
5. Agar (6.84 gr.)
6. En cada caja petri se utilizaran 19 ml de solución
7. Se utilizaran 6 cajas petri
8. Se multiplica 6 x 19 gr. para realizar regla de 3
9. Se realiza regla de 3
60gr--------1000mL
X gr.-----------114mL
_________________
6.84gr
10. se prepara medio de cultivo
11. se agita con varilla de cristal para deshacer grumos.
12. se deja hervir 57 seg.
13. se deja enfriar
14. al enfriar se tapa con torundas de algodón, selladas con masking tape donde se anotaran los datos debidos.
15. se introduce el medio de cultivo con mucho cuidado a la autoclave por 30 minutos.
½ cultivo tiempo mesa Cajas petri H20 Polvo diluido Tiempo,aut..
diluido
Agar dextrosa
saborada --------- M-2 9 171 mL 11.11 gr …
Agar verde
brillante --------- M-3 9 171 mL 9.9 gr …
Agar salmonella
y shigella --------- M-4 6 114 mL 6.84 gr
Agar mc
conkey --------- M-5 8 160 mL 8 gr …
Agar con eosina
y azul de
metileno --------- M-6 9 171 mL 6.15 gr …
ESTERILIZACION EN EL AUTOCLAVE
Una ves etiquetadas las cajas se entregan al encargado de la mesa para que introduzca los medios en la autoclave, pero es importante que se sepa muy bien sobre el uso del autoclave ya que su uso inadecuado puede ser peligroso ya que se manejen muy altas temperaturas. Los medios de cultivo duraron 20 min. en la autoclave para subir a 15 lbs. y 30 min. en la esterilización.
BITACORA:
• Equipo de bioseguridad…………………5 min
• Forrado de mesa……………………………2 min
• Obtención del material………………….2min
• Esterilización del material………………3min
• Peso de vidrio de reloj………………….3min
• Regla de tres…………………………………1min
• Vaciado de agua y agar al matraz..2min
• Agitar medio de cultivo………………..3min
• Hervir el medio de cultivo…………….57seg
• Esterilización en el autoclave……….30min
• Vaciado a cajas petri……………………..7min
• Enfriamiento de medio de cultivo…10min
Borrador
PRACTICA No. 1 MEDIOS DE CULTIVO
En esta práctica que se va a realizar se toman en cuenta las tres etapas que se refieren a pre analítica, analítica y post analítica, las cuales se deben de compaginar con la práctica secuencial.
-INSTRUCCIONES:
En el laboratorio de análisis clínicos, debe estar puntual con su equipo de bioseguridad en el laboratorio, solicitar con su vale de material para que se habiliten todos los materiales a utilizar en la práctica de medios de cultivo.
• Una vez estando dentro del laboratorio los integrantes de las mesas a trabajar deberán habilitar el equipo de esterilización “autoclave”, el cual se debe cargar con agua destilada (estudiar técnica de esterilización).
• Vestir mesa de laboratorio con papel blanco.
• Habilitar línea de gas LP, cualquiera de sus integrantes debe abrir la válvula principal para el mantenimiento de la línea, verificarlo que las válvulas principales de cada mesa estén abiertas, las cuales se encuentran por debajo de la misma.
-DESARROLLO:
1. Para realizar un medio de cultivo requerimos los siguientes materiales de cristalería, de apoyo, científicos, etc.
-MATERIALES:
Matraz erlenmeyer de 250 ml
Vaso de pp. de 50 ml
Vaso de pp. de 250 ml
Varilla de cristal como agitador
Vidrio de reloj
Cajas petri (5-7 cajas)
Espátula
Balanza granataria
Cinta masking tape
Embudo de cristal
Torundas de algodón
Papel secante
Medio de cultivo en polvo, 450 gr
Agua destilada (?)
-PRACTICA:
Re hidratamos de acuerdo a las indicaciones que están presentes en la etiqueta del medio de cultivo, la cantidad necesaria de polvo reactivo, para la elaboración de 5- 7 cajas petri, en las que se debe de usar también agua destilada en volumen.
Para poder re hidratar el polvo reactivo en medio de cultivo necesitamos manejar una regla de 3.
Pesamos el medio de cultivo en polvo que vayamos a necesitar utilizando el vidrio de reloj.
Una vez pesado l polvo se mezclara con el agua solicitada para 5 cajas petri.
Para poder mezclar adecuadamente utilizaremos el matraz erlenmeyer para la mezcla o en su caso dado para el vaso de pp., agitando con la varilla de cristal para que no queden grumos. Una vez terminado este proceso de agitación y mezcla, dejamos reposar el tiempo que nos marque la etiqueta de medio de cultivo.
En este espacio de tiempo, todo el quipo consensa su nota de desarrollo, la cual lleva gráficos, dibujos, fotos, pequeños videos y así le damos tiempo al proceso de elaboración.
Una vez reposado se tienen ya listos los mecheros de bunsen, para poder realiza el proceso de ebullición, al cual se le dará un minuto de tiempo desde que este empieza a iniciar, se realiza un pequeño giro en muñequeo, por encima de la flama azul del mechero, siendo muy cuidadosos en que el producto no se derrame del equipo donde se contiene, y q que puede ocasionar quemaduras hasta de segundo grado.
Se muñequea se observa el hervor, se retira cuidadosamente una y otra vez, tomando el tiempo, hasta que se cumple l minuto.
Una vez terminada esta acción se observa el hervor, se retira cuidadosamente un y otra ves, tomando el tiempo, hasta que se cumpla el minuto.
Una vez terminada esta acción se observa, registra y se deposita en la mesa, se deja enfriar.
Ya estando frio el medio de cultivo liquido, tamponamos con algodón, sellando con cinta masking tape, asegurando bien la boquilla del matraz, etiquetamos con el numero de mesa además la hora y la fecha.
Los encargados del equipo de esterilización, solicitaran a las mesas los medios de cultivo para ponerlos en el auto clave y esterilizarlos, donde los encargados cerraran el equipo verificando que no exista riesgo se deben utilizar guantes.
Una ves terminado el proceso de esterilización, se retira el medio de cultivo del autoclave, se deposita en medio de los dos mecheros, los cuales están encendidos, formando un campo de esterilización por radiación.
LLENADO DE CAJAS PETRI:
Deben estar dentro del campo de esterilización de la mesa, no fuera de el, para realizar el llenado con medio de cultivo y este no se contamina.
Con el vaso de pp de 50 ml realizamos la actividad de vaciado peor antes esterilizaremos la boquilla del vasito en la llave de gas, pasándolo una y otra vez una vez que se realizo la acción vaciaremos la cantidad necesaria para el llenado de la misma.
Ya baseado el material en la caja petri, se deja cernir tapada, no en su totalidad, para que no exista vapor de agua.
Ya estando solidificado el medio de cultivo, se tapa, se estiva y se asegura con masking tape, para etiquetar con los datos ya mencionados.
Si el medio de cultivo se contamina en 24, 48 y 72 horas, se vuelve a realizar la práctica pero sancionados.
PRACTICA 2. TECNICA DE ESTERILIZACION.
Es una herramienta que se ocupa para esterilizar materiales de laboratorio, reactivos o medios de cultivo y algunos otros elementos que se requieran esterilizar. La estructura de la autoclave es la base de material acerado e inoxidable y consta de los sig. Elementos:
1. Tapa de acero inoxidable con válvula de escape en su parte superior de la tapa y un manómetro con forma de reloj. El cual nos da un registro en libras y en grados centígrados y en la parte interna pende una manguerita corrugada que nos da la posibilidad de poder dejar salir el vapor que se encuentra en el interior de la autoclave.
2. La olla en su interior contiene un contenedor de aluminio con dos asas y una pequeña parrilla van a esterilizar en su parte interna tiene como sostén una parrilla de alambre que nos da la facilidad de contener la olla y que no rose con la resistencia que da la energía al equipo en le fondo se encuentra una resistencia que opera por medio de corriente alterna (amperes). La parte exterior de la autoclave se encuentra en un dispositivo de encendido una perilla de baja y alta temperatura y foco de advertencia luminoso color rojo. La parte superior de la autoclave cuenta con unos grilletes que están a base de roscas y que son la medida de seguridad al cerrar la tapa de la autoclave y debe manejarse en forma de cruz. Se va a operar en forma de cruz asegurándolos de tal manera que con ello podemos evitar un accidente. La autoclave se debe manejar en su interior con agua destilada la cual se debe medir para registrar el volumen del líquido utilizado, el que debe ir al ras de la parrilla.
3. El proceso de esterilización de este equipo se lleva en ángulo plano “Tiempo” se ocupa sistema métrico decimal, volumen y masa además sistema anglosajón que es en libras y sistema de temperaturas también vamos a hacer conversiones de grados Celsius, kelvin y Fahrenheit. Este equipo alcanza una presión de 15 libras y una temperatura de 120oC.
4. El proceso de esterilización debe de ser por tiempos, inmediatamente después de entrar al laboratorio se deben de organizar en cada una de sus practicas y preparar el rol de equipo de esterilización por calor húmedo. Iniciando la clase de laboratorio en práctica se debe encender, habilitar con agua destilada el autoclave donde se ocupan 30 min de tiempo hasta que eleve su temperatura a punto de ebullición.
5. Purgar equipo: Una vez que el equipo de autoclave esta cerrado con seguridad se deje elevar la presión y que esta llega hasta 5 libras y posteriormente se empezará a dejar salir presión a base de vapor manipulando con un guante de seguridad para una temperatura la válvula de escape y asegurarse que vuelva a quedar en 0 libras quedando así de esta manera purgado el equipo. Una vez purgado el equipo se deja subir la aguja del manómetro hasta 15 libras y se registra el tiempo de elevación de esta temperatura ya estando las 15 libras se empieza a registrar el tiempo de 30 minutos, tiempo que nos da la esterilización de los productos. La presión de 15 libras que nos da 120oC si se descuida puede ocasionar accidentes severos. EQUIPO DE ESTERILIZACION DE CALOR SECO El equipo es para realizar trabajos inmediatos en cristalería, metales, todo tipo de esterilización pero ordenada para no tener errores en la actividad. Se opera con corriente alterna (amperes), 110 volteos y alcanza temperaturas de hasta 510oC.
viernes, 15 de mayo de 2009
PRE ANALITICA 8= Aglutinación
*MATERIALES
-lamina de cristal para reacciones febriles

- tubo de ensaye con tapón rojo estéril
-palillos de madera
-torundas de algodón alcoholizadas
- centrifuga

- microscopio

- pipeta Pasteur con bulbo

- papel secante
- papel para vestir mesa
- reactivo febriclin
- paciente “sangre fresca”
-torniquete

1. Hoja de solicitud de examen
2. Hoja de laboratorio
3. Hoja para paciente
ETAPA ANALITICA
• Técnica de extracción de sangre (veno punción)
• Separación de paquete sanguíneo y plasma
• Punteo de plasma en placa de cristal
• Mezclar plasma con reactivo de febriclin para observación de reacciones de aglutinación
• Observar macroscópicamente el proceso de aglutinación en objetivo 10- 40x
• Reportamos en hoja de laboratorio
*MATERIALES
-lamina de cristal para reacciones febriles

- tubo de ensaye con tapón rojo estéril
-palillos de madera
-torundas de algodón alcoholizadas
- centrifuga

- microscopio

- pipeta Pasteur con bulbo

- papel secante
- papel para vestir mesa
- reactivo febriclin
- paciente “sangre fresca”
-torniquete

1. Hoja de solicitud de examen
2. Hoja de laboratorio
3. Hoja para paciente
ETAPA ANALITICA
• Técnica de extracción de sangre (veno punción)
• Separación de paquete sanguíneo y plasma
• Punteo de plasma en placa de cristal
• Mezclar plasma con reactivo de febriclin para observación de reacciones de aglutinación
• Observar macroscópicamente el proceso de aglutinación en objetivo 10- 40x
• Reportamos en hoja de laboratorio
CLASE
ENTEROBACTERIAS
1. Paramecium
2. Escherichia coli
3. Salmonella
4. Proteus
5. Brucella abortus
6. Prueba de aglutinación
Enfoque 100x
• Saliva
• Excremento
• Hb
• Orina
• Dermis
TECNICAS:
1. Objetivo
2. Técnica de autoclave
3. Cultivos
4. Pie de rey colonias de microorganismos
5. Frotis
6. Tinción de gran con alcohol, cetona cristal violeta, safranina, yodo lugol
7. Enfoque 100x
PRE ANALITICA Y POST ANALITICA
Practica I. Operar equipo y materiales de laboratorio asa como elaborar medios de cultivo.
- Etapa pre analítica
*practica 1. Elaborar medio de cultivo
*practica2. Esterilización de medios de cultivo
*practica3. Siembras en estría de medios de cultivo
*practica 4. Observación del desarrollo de m.o en medios de cultivo, lectura de frotis para tinción
*practica 5. Elaborar frotis para tinción
*practica 6. Tinción de gran
*practica 7. Observación microscópica
*practica 8. Prueba de reacciones febriles para prueba de aglutinación en serología.
*practica 9. Prueba de aglutinación en sangre fresca utilizando tubo con anticoagulante.
1. Paramecium
2. Escherichia coli
3. Salmonella
4. Proteus
5. Brucella abortus
6. Prueba de aglutinación
Enfoque 100x
• Saliva
• Excremento
• Hb
• Orina
• Dermis
TECNICAS:
1. Objetivo
2. Técnica de autoclave
3. Cultivos
4. Pie de rey colonias de microorganismos
5. Frotis
6. Tinción de gran con alcohol, cetona cristal violeta, safranina, yodo lugol
7. Enfoque 100x
PRE ANALITICA Y POST ANALITICA
Practica I. Operar equipo y materiales de laboratorio asa como elaborar medios de cultivo.
- Etapa pre analítica
*practica 1. Elaborar medio de cultivo
*practica2. Esterilización de medios de cultivo
*practica3. Siembras en estría de medios de cultivo
*practica 4. Observación del desarrollo de m.o en medios de cultivo, lectura de frotis para tinción
*practica 5. Elaborar frotis para tinción
*practica 6. Tinción de gran
*practica 7. Observación microscópica
*practica 8. Prueba de reacciones febriles para prueba de aglutinación en serología.
*practica 9. Prueba de aglutinación en sangre fresca utilizando tubo con anticoagulante.
TAREA 4. 3er Parcial
CENTRO DE BACHILLERATO TECNOLOGICO Industrial y de Servicios No.155
(LABORATORIO CLINICO)
MODERNIZACIÓN Y MANTENIMIENTO DE EQUIPOS PARA LABORATORIOS EXPERIMENTALES Y AULAS
BITÁCORA DE FALLA Y SEGUIMIENTO DE MANTENIMIENTO CORRECTIVO A EQUIPO DE LABORATORIO
División: P54F02
Departamento:
Nombre del Laboratorio: laboratorio UPS (Unidos Por la Salud)
SEGUIMIENTO POR EL RESPONSABLE DE LABORATORIO
"Actividad
(no aplica para laboratorio abierto)"
Fecha 15/mayo/2008
Equipo
Inventario del equipo
Tipo de falla detectada
Usuario que reporta la falla
Fecha de entrega dd/mm/aaaa
Fecha de recepción dd/mm/aaaa
Equipo en garantía (SI ó NO)
Costo aproximado de la reparación
Razón social de la empresa que realizó el mantenimiento
Supervisó operación correcta
x Docencia
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
______________________________________________________________
Elaboró
Enterado
______________________ ____________________________
JEFE DE DEPARTAMENTO RESPONSABLE DE LABORATORIO
Nombre y Firma Nombre y firma
(LABORATORIO CLINICO)
MODERNIZACIÓN Y MANTENIMIENTO DE EQUIPOS PARA LABORATORIOS EXPERIMENTALES Y AULAS
BITÁCORA DE FALLA Y SEGUIMIENTO DE MANTENIMIENTO CORRECTIVO A EQUIPO DE LABORATORIO
División: P54F02
Departamento:
Nombre del Laboratorio: laboratorio UPS (Unidos Por la Salud)
SEGUIMIENTO POR EL RESPONSABLE DE LABORATORIO
"Actividad
(no aplica para laboratorio abierto)"
Fecha 15/mayo/2008
Equipo
Inventario del equipo
Tipo de falla detectada
Usuario que reporta la falla
Fecha de entrega dd/mm/aaaa
Fecha de recepción dd/mm/aaaa
Equipo en garantía (SI ó NO)
Costo aproximado de la reparación
Razón social de la empresa que realizó el mantenimiento
Supervisó operación correcta
x Docencia
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
Docencia
______________________________________________________________
Investigación
Curso
Proyecto Nombre Nombre y Firma.
______________________________________________________________
Elaboró
Enterado
______________________ ____________________________
JEFE DE DEPARTAMENTO RESPONSABLE DE LABORATORIO
Nombre y Firma Nombre y firma
miércoles, 13 de mayo de 2009
TAREA 3. 3er Parcial
TAREA 3.
Investigar el concepto de tinción
Clasificación de tinciones
Tinción directa
Tinción indirecta
Tinción por azul de metileno o cristal violeta
Tinción de Grahm
Tinción de Ziehl Neelsen
TincionExisten múltiples métodos de tinción histológica, unos generales y otros específicos, que permiten poner de manifiesto tanto la topografía tisular, como tipos celulares concretos, determinados orgánulos o estructuras intracelulares.
Las tinciones histológicas propiamente dichas utilizan colorantes, la mayor parte de ellos derivados de la industria textil, que se eligen en función de su capacidad de interaccionar con los diferentes constituyentes de los tejidos. Técnicas de tinción más complejas como las histoenzimáticas o inmunocitoquímicas se basan en el empleo de sustratos, lectinas, anticuerpos, etc.
Tincion directaEn una tinción directa el colorante interacciona directamente con el sustrato.
Tinción indirecta
En una tinción indirecta se hace interaccionar en primer lugar a una sustancia química denominada "mordiente" con el sustrato la cual permite la posterior interacción del colorante. Usualmente los mordientes son sales, hidróxidos o alumbres de metales bivalentes o trivalentes.
Tinción por azul de metileno o cristal violetaEl azul de metileno es un buen colorante simple que actúa sobre todas las células bacterianas rápidamente y que no produce un color tan intenso que oscurezca los detalles celulares. Es especialmente útil para detectar la presencia de bacterias en muestras naturales, puesto que la mayor parte del material no celular no se tiñe.

Tinción de Gram
La tinción de Gram o coloración Gram es un tipo de tinción diferencial empleado en microbiología para la visualización de bacterias, sobre todo en muestras clínicas. Debe su nombre al bacteriólogo danés Christian Gram, que desarrolló la técnica en 1884. Se utiliza tanto para poder referirse a la morfología celular bacteriana como para poder realizar una primera aproximación a la diferenciación bacteriana, considerándose Bacteria Gram positiva a las bacterias que se visualizan de color violeta y Bacteria Gram negativa a las que se visualizan de color rosa.

Tinción de Ziehl Neelsen
La tinción de Ziehl-Neelsen (BAAR) es una técnica de tinción diferencial rápida y económica, para la identificación de mocroorganismos patógenos, por ejemplo M. tuberculosis.
Fue descrita por primera vez por dos médicos alemanes, Franz Ziehl (1859 to 1926), un bacteriólogo y Friedrich Neelsen (1854 to 1894), un patólogo.
Este método se basa en que las paredes celulares de ciertos parásitos y bacterias contienen ácidos grasos (por ejemplo, el ácido micólico) de cadena larga (50 a 90 átomos de carbono) que les confieren la propiedad de resistir la decoloración con alcohol-ácido, después de la tinción con colorantes básicos. Por esto se denominan bacilos ácido-alcohol resistentes o BAAR. Las micobacterias como M. tuberculosis y M. marinum y los parásitos coccídeos como Cryptosporidium se caracterizan por sus propiedades de ácido-alcohol resistencia. La coloración clásica de Ziehl-Neelsen requiere calentamiento para que el colorante atraviese la pared bacteriana que contiene ceras.

Investigar el concepto de tinción
Clasificación de tinciones
Tinción directa
Tinción indirecta
Tinción por azul de metileno o cristal violeta
Tinción de Grahm
Tinción de Ziehl Neelsen
TincionExisten múltiples métodos de tinción histológica, unos generales y otros específicos, que permiten poner de manifiesto tanto la topografía tisular, como tipos celulares concretos, determinados orgánulos o estructuras intracelulares.
Las tinciones histológicas propiamente dichas utilizan colorantes, la mayor parte de ellos derivados de la industria textil, que se eligen en función de su capacidad de interaccionar con los diferentes constituyentes de los tejidos. Técnicas de tinción más complejas como las histoenzimáticas o inmunocitoquímicas se basan en el empleo de sustratos, lectinas, anticuerpos, etc.
Tincion directaEn una tinción directa el colorante interacciona directamente con el sustrato.
Tinción indirecta
En una tinción indirecta se hace interaccionar en primer lugar a una sustancia química denominada "mordiente" con el sustrato la cual permite la posterior interacción del colorante. Usualmente los mordientes son sales, hidróxidos o alumbres de metales bivalentes o trivalentes.
Tinción por azul de metileno o cristal violetaEl azul de metileno es un buen colorante simple que actúa sobre todas las células bacterianas rápidamente y que no produce un color tan intenso que oscurezca los detalles celulares. Es especialmente útil para detectar la presencia de bacterias en muestras naturales, puesto que la mayor parte del material no celular no se tiñe.

Tinción de Gram
La tinción de Gram o coloración Gram es un tipo de tinción diferencial empleado en microbiología para la visualización de bacterias, sobre todo en muestras clínicas. Debe su nombre al bacteriólogo danés Christian Gram, que desarrolló la técnica en 1884. Se utiliza tanto para poder referirse a la morfología celular bacteriana como para poder realizar una primera aproximación a la diferenciación bacteriana, considerándose Bacteria Gram positiva a las bacterias que se visualizan de color violeta y Bacteria Gram negativa a las que se visualizan de color rosa.

Tinción de Ziehl Neelsen
La tinción de Ziehl-Neelsen (BAAR) es una técnica de tinción diferencial rápida y económica, para la identificación de mocroorganismos patógenos, por ejemplo M. tuberculosis.
Fue descrita por primera vez por dos médicos alemanes, Franz Ziehl (1859 to 1926), un bacteriólogo y Friedrich Neelsen (1854 to 1894), un patólogo.
Este método se basa en que las paredes celulares de ciertos parásitos y bacterias contienen ácidos grasos (por ejemplo, el ácido micólico) de cadena larga (50 a 90 átomos de carbono) que les confieren la propiedad de resistir la decoloración con alcohol-ácido, después de la tinción con colorantes básicos. Por esto se denominan bacilos ácido-alcohol resistentes o BAAR. Las micobacterias como M. tuberculosis y M. marinum y los parásitos coccídeos como Cryptosporidium se caracterizan por sus propiedades de ácido-alcohol resistencia. La coloración clásica de Ziehl-Neelsen requiere calentamiento para que el colorante atraviese la pared bacteriana que contiene ceras.

TAREA 2. 3er Parcial

TAREA 2.
• Concepto de medio de cultivo.
• Clasificación de medios de cultivo.
3. Tipos de siembras
Medio de cultivo
Solución que cuenta con los nutrientes necesarios para recuperar, multiplicar, aislar e identificar los microorganismos (bajo condiciones favorables de temperatura y pH), así como efectuar pruebas de susceptibilidad. Generalmente se presentan desecados en forma de polvo fino o granular antes de ser preparados, al prepararse podemos encontrarlos en estado sólido, semisólido y líquido.
CLASIFICACION.
Según su aspecto físico:
• fosiferoliquidos
• Semi-sólidos
• Sólidos duros o muy duros
Según su uso:
• Selectivos
• Selectivos de enriquecimiento
• Diferenciales
• Para cultivar gérmenes anaerobios
• Para medir potencia de antibióticos
• De transporte en micro
• Para filtración a través de membrana
• Para cultivo de hongos y levaduras
• Para cultivo de protozoarios
TAREA 1. 3er Parcial
Tarea 1.
1. Investigar bibliográficamente y de forma digital las características del microorganismo denominado: Paramecio que pertenece al grupo de los protozoarios.
Paramecium
Los paramecios (género Paramecium) son protozoos ciliados con forma de suela de zapato o elipsoide, habituales en aguas dulces estancadas con abundante materia orgánica, como charcos y estanques. Son probablemente los seres unicelulares mejor conocidos y los protozoos ciliados más estudiados por la Ciencia. El tamaño ordinario de todas las especies de paramecios es de apenas 0'05 milímetros.
Carecen de flagelos, pero los cilios son muy abundantes y recubren toda su superficie. A ellos les corresponde proporcionar movimiento al organismo. La membrana externa absorbe y expulsa regularmente el agua del exterior con el fin de controlar la osmorregulación, proceso dirigido por dos vacuolas contráctiles.
En su anatomía destaca el citostoma, una especie de invaginación situada a todo lo largo del paramecio de la que éste se sirve para capturar el alimento, conformado por partículas orgánicas flotantes y microorganismos menores. El citostoma conduce a una cito faringe antes de que el alimento pase al interior de este protozoo. Otros orgánulos de fácil observación son el núcleo eucariota, situado junto a un "micro núcleo" en el centro del paramecio, y las vacuolas digestivas, que digieren constantemente el alimento capturado. Los desechos se expulsan por exocitosis, mediante vacuolas de secreción que se originan a partir de las digestivas.
Como muchos otros microorganismos, los paramecios se reproducen asexualmente por fisión binaria.

2. Investigar las características de los siguientes microorganismos pertenecientes al grupo de las entero bacterias:
a) Escherichia coli
b) Salmonella tiphy
c) Proteus
d) Brucella abortus
Escherichia coli
Escherichia coli (E. coli) es quizás el organismo procarionte más estudiado por el ser humano, se trata de una bacteria que se encuentra generalmente en los intestinos animales y por ende en las aguas negras. Fue descrita por primera vez en 1885 por Theodore von Escherich, bacteriólogo alemán, quién la denominó Bacterium coli. Posteriormente la taxonomía le adjudicó el nombre de Escherichia coli, en honor a su descubridor. Ésta y otras bacterias son necesarias para el funcionamiento correcto del proceso digestivo. Además produce vitaminas B y K. Es un bacilo que reacciona negativamente a la tinción de Gram (gramnegativo), es anaeróbico facultativo, móvil por flagelos peritricos (que rodean su cuerpo), no forma esporas, es capaz de fermentar la glucosa y la lactosa y su prueba de IMVIC es ++--.
Es una bacteria utilizada frecuentemente en experimentos de genética y biotecnología molecular.

Salmonella tiphy
Salmonella spp. Es un bacilo Gram-negativo, móvil.
Está ampliamente presente en todos los animales.
Sus fuentes ambientales incluyen: agua, insectos, alimentos y superficies tanto de fábricas, cocinas, etc.
Salmonella es un género de bacteria que pertenece a la familia Enterobacteriaceae, formado por bacilos gramnegativos, anaerobios facultativos, con flagelos perítricos y que no desarrollan cápsula ni esporas. Son bacterias móviles que producen sulfuro de hidrógeno (H2S). Fermentan glucosa por poseer una enzima especializada, pero no lactosa, y no producen ureasa.
Es un agente zoonótico de distribución universal. Se transmite por contacto directo o contaminación cruzada durante la manipulación, en el procesado de alimentos o en el hogar, también por vía sexual.
Algunas salmonellas son comunes en la piel de tortugas y de muchos reptiles, lo cual puede ser importante cuando se manipulan a la vez este tipo de mascotas y alimentos.

Proteus
Proteus es un género de bacterias gramnegativas, que incluye patógenos responsables de muchas infecciones del tracto urinario.1 Las especies de Proteus normalmente no fermentan lactosa por razón de tener una β galactosidasa, pero algunas se han mostrado capaces de hacerlo en el test TSI (Triple Sugar Iron). Son oxidasa-negativas y ureasa-positivas. Algunas especies son mótiles.2 Tienden a ser organismos pleomórficos, no esporulados ni capsulados y son productoras de fenilalanina desaminasa.3 Con la excepción de P. mirabilis, todos los Proteus reaccionan negativos con la prueba del indol. Proteus es un género de bacterias ubicuo, residentes del tracto intestinal del hombre y otros animales.
Crecen en medios corrientes y moderadamente selectivos a temperatura corporal de 37ºC. Crecen formando capas diseminadas por virtud de su gran motilidad. Existen variantes inmóviles que forman colonias lisas.

BRUCELLA ABORTUS
La brucelosis, también conocida como fiebre de Malta, es una enfermedad infecciosa que se presenta con episodios recurrentes de fiebre, debilidad, sudoración y dolores vagos. Es provocada por una bacteria llamada Brucella, que está en la sangre, las secreciones y la leche de vacas, cerdos, ovejas y cabras. Brucella abortus es el microorganismo implicado con mayor frecuencia en la brucelosis bovina y es poco frecuente en nuestro país. La Brucella tiene capacidad de sobrevivir en el interior de las células fagocíticas. Este hecho determina la clínica característica, el curso ondulante, su tendencia a presentar recaídas y su frecuente evolución a formas crónicas.
B. abortus es una bacteria Gram negativa con un lipopolisacárido (LPS) fuertemente inmunodominante, el que junto con la capacidad de sobrevivir en el interior de células fagocíticas constituyen sus principales factores de virulencia. La infección en humanos conduce a una enfermedad con tendencia a la cronicidad, con fiebre y malestar recurrentes que deterioran su calidad de vida y que además puede presentar complicaciones como artritis, meningitis, entre otras.
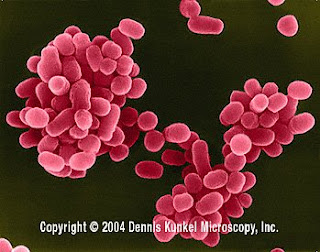
1. Investigar bibliográficamente y de forma digital las características del microorganismo denominado: Paramecio que pertenece al grupo de los protozoarios.
Paramecium
Los paramecios (género Paramecium) son protozoos ciliados con forma de suela de zapato o elipsoide, habituales en aguas dulces estancadas con abundante materia orgánica, como charcos y estanques. Son probablemente los seres unicelulares mejor conocidos y los protozoos ciliados más estudiados por la Ciencia. El tamaño ordinario de todas las especies de paramecios es de apenas 0'05 milímetros.
Carecen de flagelos, pero los cilios son muy abundantes y recubren toda su superficie. A ellos les corresponde proporcionar movimiento al organismo. La membrana externa absorbe y expulsa regularmente el agua del exterior con el fin de controlar la osmorregulación, proceso dirigido por dos vacuolas contráctiles.
En su anatomía destaca el citostoma, una especie de invaginación situada a todo lo largo del paramecio de la que éste se sirve para capturar el alimento, conformado por partículas orgánicas flotantes y microorganismos menores. El citostoma conduce a una cito faringe antes de que el alimento pase al interior de este protozoo. Otros orgánulos de fácil observación son el núcleo eucariota, situado junto a un "micro núcleo" en el centro del paramecio, y las vacuolas digestivas, que digieren constantemente el alimento capturado. Los desechos se expulsan por exocitosis, mediante vacuolas de secreción que se originan a partir de las digestivas.
Como muchos otros microorganismos, los paramecios se reproducen asexualmente por fisión binaria.

2. Investigar las características de los siguientes microorganismos pertenecientes al grupo de las entero bacterias:
a) Escherichia coli
b) Salmonella tiphy
c) Proteus
d) Brucella abortus
Escherichia coli
Escherichia coli (E. coli) es quizás el organismo procarionte más estudiado por el ser humano, se trata de una bacteria que se encuentra generalmente en los intestinos animales y por ende en las aguas negras. Fue descrita por primera vez en 1885 por Theodore von Escherich, bacteriólogo alemán, quién la denominó Bacterium coli. Posteriormente la taxonomía le adjudicó el nombre de Escherichia coli, en honor a su descubridor. Ésta y otras bacterias son necesarias para el funcionamiento correcto del proceso digestivo. Además produce vitaminas B y K. Es un bacilo que reacciona negativamente a la tinción de Gram (gramnegativo), es anaeróbico facultativo, móvil por flagelos peritricos (que rodean su cuerpo), no forma esporas, es capaz de fermentar la glucosa y la lactosa y su prueba de IMVIC es ++--.
Es una bacteria utilizada frecuentemente en experimentos de genética y biotecnología molecular.

Salmonella tiphy
Salmonella spp. Es un bacilo Gram-negativo, móvil.
Está ampliamente presente en todos los animales.
Sus fuentes ambientales incluyen: agua, insectos, alimentos y superficies tanto de fábricas, cocinas, etc.
Salmonella es un género de bacteria que pertenece a la familia Enterobacteriaceae, formado por bacilos gramnegativos, anaerobios facultativos, con flagelos perítricos y que no desarrollan cápsula ni esporas. Son bacterias móviles que producen sulfuro de hidrógeno (H2S). Fermentan glucosa por poseer una enzima especializada, pero no lactosa, y no producen ureasa.
Es un agente zoonótico de distribución universal. Se transmite por contacto directo o contaminación cruzada durante la manipulación, en el procesado de alimentos o en el hogar, también por vía sexual.
Algunas salmonellas son comunes en la piel de tortugas y de muchos reptiles, lo cual puede ser importante cuando se manipulan a la vez este tipo de mascotas y alimentos.

Proteus
Proteus es un género de bacterias gramnegativas, que incluye patógenos responsables de muchas infecciones del tracto urinario.1 Las especies de Proteus normalmente no fermentan lactosa por razón de tener una β galactosidasa, pero algunas se han mostrado capaces de hacerlo en el test TSI (Triple Sugar Iron). Son oxidasa-negativas y ureasa-positivas. Algunas especies son mótiles.2 Tienden a ser organismos pleomórficos, no esporulados ni capsulados y son productoras de fenilalanina desaminasa.3 Con la excepción de P. mirabilis, todos los Proteus reaccionan negativos con la prueba del indol. Proteus es un género de bacterias ubicuo, residentes del tracto intestinal del hombre y otros animales.
Crecen en medios corrientes y moderadamente selectivos a temperatura corporal de 37ºC. Crecen formando capas diseminadas por virtud de su gran motilidad. Existen variantes inmóviles que forman colonias lisas.

BRUCELLA ABORTUS
La brucelosis, también conocida como fiebre de Malta, es una enfermedad infecciosa que se presenta con episodios recurrentes de fiebre, debilidad, sudoración y dolores vagos. Es provocada por una bacteria llamada Brucella, que está en la sangre, las secreciones y la leche de vacas, cerdos, ovejas y cabras. Brucella abortus es el microorganismo implicado con mayor frecuencia en la brucelosis bovina y es poco frecuente en nuestro país. La Brucella tiene capacidad de sobrevivir en el interior de las células fagocíticas. Este hecho determina la clínica característica, el curso ondulante, su tendencia a presentar recaídas y su frecuente evolución a formas crónicas.
B. abortus es una bacteria Gram negativa con un lipopolisacárido (LPS) fuertemente inmunodominante, el que junto con la capacidad de sobrevivir en el interior de células fagocíticas constituyen sus principales factores de virulencia. La infección en humanos conduce a una enfermedad con tendencia a la cronicidad, con fiebre y malestar recurrentes que deterioran su calidad de vida y que además puede presentar complicaciones como artritis, meningitis, entre otras.

viernes, 8 de mayo de 2009
PRACTICA. PIPETEO
*Índice:
-Objetivo de la práctica
-Introducción
-Desarrollo de la práctica
-Bitácora
-Conclusión
*Objetivo:
Esta práctica tiene como objetivo, que nosotros los alumnos pongamos en práctica los conocimientos anteriormente vistos y aprendamos a medir cantidades en volumen, así como el manejo adecuado de pipetas, probetas y matraces, ya que será lo que posteriormente utilizaremos mas adelante
*Introducción:
En esta práctica llamada “Pipeteo” realizaremos algunos procedimientos que nos sirven para mejorar las perfecciones de medidas y como utilizar las pipetas volumétricas y automáticas, así como saber medir bien los mililitros y aprender a pipetear sustancias que en este caso fue agua.
*Material:
-Probeta graduada 25ml
-Probeta graduada 100ml
-Matraz erlenmeyer 250ml
-Pipeta Pasteur
-Pipeta graduada volumétrica 10ml
-Pipeta volumétrica 5ml
-Pipeta automática
-Pipeta volumétrica de 1000ml
-Lóbulo
-Agua
*Marco teorico
-Procedimiento: Cada uno de los integrantes realizara la misma actividad, se pipeteara con las 5 pipetas entregadas y se colocara la muestra del liquido en la probeta, se pipetearan desde 1ml hasta 5 ml. Una vez hecho eso se colocara una gota de cada pipeta en una caja de petri y se compararan sus tamaños.
-Nota: Pipeta Pasteur, se aprieta el lóbulo para succionar el agua contenida en el matraz Erlenmeyer hacia la probeta, al utilizarla 5 veces se llego a los 3 ml
-Pipeta volumétrica ( 1ml): Se succiona el agua con la boca, después lo colocamos en la probeta graduada y comprobamos que aspira mas realmente 1 ml de agua
-Pipeta volumétrica (5ml): Se succiona con la boca, sostenemos con el menisco, soltamos y ponemos el agua en la probeta comprobando que si son 5ml exactos.
-Pipeta graduada (10ml): Se aspira el agua, de igual modo sostenemos con el menisco hasta el 10, luego colocamos el líquido en la probeta donde comprobamos que son 10 ml
-Comparación de gotas:
1.- Pipeta Pasteur (gota mas pequeña)
2.- Pipeta automática en 10micro litros (gota mediana pequeña)
3.- Pipeta graduada de 1ml (gota mediana)
4.-Pipeta volumétrica 5ml (gota mediana, grande)
5.- Pipeta graduada volumétrica 10ml (grande)
*Bitácora:
-Colocación del equipo de bioseguridad………………………..5min
-Explicación del profesor…………………………………………10min
-Recolección de material…………………………………………5min
-Realización de practica………………………………………….1hora
-Retirar equipo de bioseguridad………………………………..5min
*Conclusión:
Esta practica como todas las demás ya realizadas son importantes pues aprendemos nuevas cosas que nos serán de gran ayuda mas adelante, en este caso, el pipeteo de sustancias asi como aprender a utilizar correctamente los materiales como las pipetas y saber medir correctamente las cantidades.
-Objetivo de la práctica
-Introducción
-Desarrollo de la práctica
-Bitácora
-Conclusión
*Objetivo:
Esta práctica tiene como objetivo, que nosotros los alumnos pongamos en práctica los conocimientos anteriormente vistos y aprendamos a medir cantidades en volumen, así como el manejo adecuado de pipetas, probetas y matraces, ya que será lo que posteriormente utilizaremos mas adelante
*Introducción:
En esta práctica llamada “Pipeteo” realizaremos algunos procedimientos que nos sirven para mejorar las perfecciones de medidas y como utilizar las pipetas volumétricas y automáticas, así como saber medir bien los mililitros y aprender a pipetear sustancias que en este caso fue agua.
*Material:
-Probeta graduada 25ml
-Probeta graduada 100ml
-Matraz erlenmeyer 250ml
-Pipeta Pasteur
-Pipeta graduada volumétrica 10ml
-Pipeta volumétrica 5ml
-Pipeta automática
-Pipeta volumétrica de 1000ml
-Lóbulo
-Agua
*Marco teorico
-Procedimiento: Cada uno de los integrantes realizara la misma actividad, se pipeteara con las 5 pipetas entregadas y se colocara la muestra del liquido en la probeta, se pipetearan desde 1ml hasta 5 ml. Una vez hecho eso se colocara una gota de cada pipeta en una caja de petri y se compararan sus tamaños.
-Nota: Pipeta Pasteur, se aprieta el lóbulo para succionar el agua contenida en el matraz Erlenmeyer hacia la probeta, al utilizarla 5 veces se llego a los 3 ml
-Pipeta volumétrica ( 1ml): Se succiona el agua con la boca, después lo colocamos en la probeta graduada y comprobamos que aspira mas realmente 1 ml de agua
-Pipeta volumétrica (5ml): Se succiona con la boca, sostenemos con el menisco, soltamos y ponemos el agua en la probeta comprobando que si son 5ml exactos.
-Pipeta graduada (10ml): Se aspira el agua, de igual modo sostenemos con el menisco hasta el 10, luego colocamos el líquido en la probeta donde comprobamos que son 10 ml
-Comparación de gotas:
1.- Pipeta Pasteur (gota mas pequeña)
2.- Pipeta automática en 10micro litros (gota mediana pequeña)
3.- Pipeta graduada de 1ml (gota mediana)
4.-Pipeta volumétrica 5ml (gota mediana, grande)
5.- Pipeta graduada volumétrica 10ml (grande)
*Bitácora:
-Colocación del equipo de bioseguridad………………………..5min
-Explicación del profesor…………………………………………10min
-Recolección de material…………………………………………5min
-Realización de practica………………………………………….1hora
-Retirar equipo de bioseguridad………………………………..5min
*Conclusión:
Esta practica como todas las demás ya realizadas son importantes pues aprendemos nuevas cosas que nos serán de gran ayuda mas adelante, en este caso, el pipeteo de sustancias asi como aprender a utilizar correctamente los materiales como las pipetas y saber medir correctamente las cantidades.
VERNIER
El calibre, también denominado cartabón de corredera, pie de rey, pie de metro, pie a coliza o Vernier, es un instrumento para medir dimensiones de objetos relativamente pequeños, desde centímetros hasta fracciones de milímetros (1/10 de milímetro, 1/20 de milímetro, 1/50 de milímetro). En la escala de las pulgadas tiene divisiones equivalentes a 1/16 de pulgada, y, en su nonio, de 1/128 de pulgadas.
Es un instrumento sumamente delicado y debe maniobrarse con habilidad, cuidado y delicadeza, con precaución de no rayarlo ni doblarlo (en especial, la coliza de profundidad).
El primer instrumento de características similares fue encontrado en un naufragio en la isla de Giglio, cerca de la costa italiana, datado en el siglo VI a.C. Aunque considerado raro, fue usado por griegos y romanos. Durante la Dinastía Han (202 a.C. - 220 d.C.), también se utilizó un instrumento similar en China, hecho de bronce, hallado con una inscripción del día, mes y año en que se realizó.
Se atribuye al cosmógrafo y matemático portugués Pedro Núñez (1492-1577) —que inventó el nonio o nonius—, el origen del pie de rey. También se ha llamado pie de rey al vernier, porque hay quien atribuye su invento al geómetra Pierre Vernier (1580-1637), aunque lo que verdaderamente inventó fue la regla de cálculo vernier, que ha sido confundida con el nonio inventado por Pedro Núñez. En castellano, se utiliza con frecuencia la voz nonio para definir esa escala.
El calibre moderno con nonio y lectura de milésimas de pulgada, fue inventado por el americano Joseph R. Brown en 1851. Fue el primer instrumento práctico para efectuar mediciones de precisión que pudo ser vendido a un precio asequible.
Es un instrumento sumamente delicado y debe maniobrarse con habilidad, cuidado y delicadeza, con precaución de no rayarlo ni doblarlo (en especial, la coliza de profundidad).
El primer instrumento de características similares fue encontrado en un naufragio en la isla de Giglio, cerca de la costa italiana, datado en el siglo VI a.C. Aunque considerado raro, fue usado por griegos y romanos. Durante la Dinastía Han (202 a.C. - 220 d.C.), también se utilizó un instrumento similar en China, hecho de bronce, hallado con una inscripción del día, mes y año en que se realizó.
Se atribuye al cosmógrafo y matemático portugués Pedro Núñez (1492-1577) —que inventó el nonio o nonius—, el origen del pie de rey. También se ha llamado pie de rey al vernier, porque hay quien atribuye su invento al geómetra Pierre Vernier (1580-1637), aunque lo que verdaderamente inventó fue la regla de cálculo vernier, que ha sido confundida con el nonio inventado por Pedro Núñez. En castellano, se utiliza con frecuencia la voz nonio para definir esa escala.
El calibre moderno con nonio y lectura de milésimas de pulgada, fue inventado por el americano Joseph R. Brown en 1851. Fue el primer instrumento práctico para efectuar mediciones de precisión que pudo ser vendido a un precio asequible.
CUESTIONARIO 1 SEGUNDA UNIDAD
1.es un instrumento para medir dimensiones de objetos relativamente pequeños, se atribuye al cosmpgrafo y matematico portugues, que se llama:
Pedro Nuñez
2.en que año se le atribuye el pie de rey al cosmografo y matematico portugues:
1851
3. tambien se ha llamado pie de rey:
Pie de Vernier
4. en que año se le atribuye al geometra Pedro Vernier:
1631
5.¿Que otro nombre recibe el origen del pie de rey?
Vernier
6. en los recuadros siguientes ponga el numero y nombre correspondiente de la figura de medicion:

1.mordazas para medidas externas
2.mordazas para medidad internas
3.coliza para medidas de profundidades
4.escala con divisiones en cm y mm
5.escala con divisiones en pulgadas y fracciones de mm en que este dividido
6.nanio para la lectura de las fracciones de mm en que este dividido
7.nanio para la lectura de las fracciones de pulgada en que este dividido
8.boton de deslizamiento y freno
Pedro Nuñez
2.en que año se le atribuye el pie de rey al cosmografo y matematico portugues:
1851
3. tambien se ha llamado pie de rey:
Pie de Vernier
4. en que año se le atribuye al geometra Pedro Vernier:
1631
5.¿Que otro nombre recibe el origen del pie de rey?
Vernier
6. en los recuadros siguientes ponga el numero y nombre correspondiente de la figura de medicion:

1.mordazas para medidas externas
2.mordazas para medidad internas
3.coliza para medidas de profundidades
4.escala con divisiones en cm y mm
5.escala con divisiones en pulgadas y fracciones de mm en que este dividido
6.nanio para la lectura de las fracciones de mm en que este dividido
7.nanio para la lectura de las fracciones de pulgada en que este dividido
8.boton de deslizamiento y freno
BACTERIAS EN MEDIO DE CULTIVO
-Realizar problemas correspondientes a medios de cultivo (reactivo)
1.-Anotar el nombre del medio de cultivo que nos facilita, con todos los datos visibles en su etiqueta.
2.- Leer cuidadosamente las indicaciones que contiene el bote de medio de cultivo
3.- Rehidratar el contenido en gr. Para 1000ml del cual deberá ocupar un porcentaje para rehidratar en 250 ml, 165ml. y 138ml
4.- Las operaciones deben de ser con números básicos como suma, resta, multiplicación y división para poder ejecutar regla de tres.
5.- Tema de investigación: Investigar tipo de bacteria que crece en los medios de cultivo habilitados.
Ejercicio:
1.- Anotar nombre completo y datos visibles
- Base de agar sangre
- Formula gr. Por Litro:
-Agar__________150
-Cloruro de sodio___________5.0
-Infusión de músculo caroliaco_________10.0
- Preptona________10.0
pH 7.3 +/- 0.2
Registro Nº 0123R84 SSA
Contenido Neto: 450gr.
Lote Nº: 5957123
Caducidad: 05-Feb-07
Catalogo Nº 1031-A
2.- Rehidratar el contenido en gr. Para 1000ml. del cual deberá ocupar un porcentaje para rehidratar en 250ml, 175ml y 138ml
40---->1000ml
X ---->250ml
X= (40gr)(250ml)/1000ml
X= 10gr
40---->1000ml
X ---->175ml
X= (40gr)(175ml)/1000ml
X= 7gr.
40------>1000ml
X ------>138ml
X= (40gr)(138ml)/1000ml
X= 5.52 gr.
BACTERIAS QUE SE DESARROLLAN EN LOS MEDIOS DE CULTIVO HABILITADOS
Cuando se desea cultivar bacterias, es necesario tomar en cuenta los componentes nutritivos, sales, humedad y las condiciones físicas como lo son el pH, la luz y temperatura
Una bacteria puede alterar el pH del medio de cultivo como resultado de la degradación de sustancias producidas por la propia bacteria
Por otro lado, las bacterias en su conjunto presentan una respuesta variable al oxigeno libre clasificándose en cinco grupos:
*Aeróbicas: Bacterias que crecen en presencia de oxigeno libre.
*Anaeróbicas: Bacterias que crecen en ausencia de oxigeno libre
*Anaeróbicas facultativas: Bacterias que crecen en presencia como en ausencia de oxigeno libre.
*Aerotolerantes: Bacterias que pueden tolerar el oxigeno y crecen en su presencia aun cuando no lo utilizan
*Microaerofilas: Bacterias que crecen en presencia de de pequeñas cantidades de oxigeno libre.
1.-Anotar el nombre del medio de cultivo que nos facilita, con todos los datos visibles en su etiqueta.
2.- Leer cuidadosamente las indicaciones que contiene el bote de medio de cultivo
3.- Rehidratar el contenido en gr. Para 1000ml del cual deberá ocupar un porcentaje para rehidratar en 250 ml, 165ml. y 138ml
4.- Las operaciones deben de ser con números básicos como suma, resta, multiplicación y división para poder ejecutar regla de tres.
5.- Tema de investigación: Investigar tipo de bacteria que crece en los medios de cultivo habilitados.
Ejercicio:
1.- Anotar nombre completo y datos visibles
- Base de agar sangre
- Formula gr. Por Litro:
-Agar__________150
-Cloruro de sodio___________5.0
-Infusión de músculo caroliaco_________10.0
- Preptona________10.0
pH 7.3 +/- 0.2
Registro Nº 0123R84 SSA
Contenido Neto: 450gr.
Lote Nº: 5957123
Caducidad: 05-Feb-07
Catalogo Nº 1031-A
2.- Rehidratar el contenido en gr. Para 1000ml. del cual deberá ocupar un porcentaje para rehidratar en 250ml, 175ml y 138ml
40---->1000ml
X ---->250ml
X= (40gr)(250ml)/1000ml
X= 10gr
40---->1000ml
X ---->175ml
X= (40gr)(175ml)/1000ml
X= 7gr.
40------>1000ml
X ------>138ml
X= (40gr)(138ml)/1000ml
X= 5.52 gr.
BACTERIAS QUE SE DESARROLLAN EN LOS MEDIOS DE CULTIVO HABILITADOS
Cuando se desea cultivar bacterias, es necesario tomar en cuenta los componentes nutritivos, sales, humedad y las condiciones físicas como lo son el pH, la luz y temperatura
Una bacteria puede alterar el pH del medio de cultivo como resultado de la degradación de sustancias producidas por la propia bacteria
Por otro lado, las bacterias en su conjunto presentan una respuesta variable al oxigeno libre clasificándose en cinco grupos:
*Aeróbicas: Bacterias que crecen en presencia de oxigeno libre.
*Anaeróbicas: Bacterias que crecen en ausencia de oxigeno libre
*Anaeróbicas facultativas: Bacterias que crecen en presencia como en ausencia de oxigeno libre.
*Aerotolerantes: Bacterias que pueden tolerar el oxigeno y crecen en su presencia aun cuando no lo utilizan
*Microaerofilas: Bacterias que crecen en presencia de de pequeñas cantidades de oxigeno libre.
PESOS Y MEDIDAS
INDICE
Objetivo
Introducción
Desarrollo
Bitácora
Conclusión
Fuentes de consulta
OBJETIVO DE LA PRÁCTICA
En la práctica se tiene como principal objetivo el uso de la balanza, así como también que el alumno se familiarice con diversos instrumentos como (cristalería, entre otros). En la practica se quiere conocer los pesos del objeto o con un reactivo, esto con ayuda de la balanza granataria.
INTRODUCCION
Dicha práctica tiene el nombre de “Pesos y medidas” y se realiza con el fin de conocer medidas de los pesos correspondientes a los instrumentos dados. Para esto los instrumentos se pesaran en la balanza granataria, la cual debe estar balanceada, para tratar que el peso dado sea exacto y correcto. Esta práctica es el primer paso para la preparación del cultivo.
MARCO TEORICO
Material:
-Azúcar
-Sal
-vaso de pp50ml
-vaso de pp 500ml
-laminilla de cristal
-Caja de petri
-probeta
-tubo de ensayo
-vidrio de reloj
-cristalizador
-pipeta graduada 5ml
-pipeta volumétrica
-pipeta Pasteur
-pipeta de Salí
-manguera con boquilla
-espátula
-pipeta graduada
La práctica consiste en pesar en la balanza granataria los materiales indicados. Para ello primeramente debemos pedir el material necesario, observar si la balanza granataria esta bien balanceada y después empezar a pesar los instrumentos. Cada integrante del equipo deberá pesar por lo menos un material y anotar sus observaciones.
-Pasos
1. El alumno debe de portar su equipo de bioseguridad correctamente.
2. Observar si la balanza esta correctamente balanceada.
3. Colocar los instrumentos en la balanza y anotar su peso.
4. Se realizara el mismo procedimiento con los demás materiales.
5. Se pesa el vaso de pp. de 50 ml con azúcar primero y después con sal, así como vacio.
6. Por ultimo se registran los datos obtenidos.
7. Se limpian los instrumentos usados y se guardan en orden.
Pesos registrados.
Vaso de pp 50ml
28 gr
Vaso de pp 500ml
116gr
Laminilla de cristal
53.6gr
Caja petri
71 gr
Probeta graduada
145 gr
Tubo de ensayo
17.9 gr
Vidrio de reloj
55.4 gr
Cristalizador
21.8 gr
Volumetrica
22.6 gr
Pipeta pasteur
5.6 gr
Pipeta de Sali con manguera
7.3 gr
Espatula
49.5gr
Pipeta graduada de 1ml
3.4 gr
Agua destilada
5.4 gr
Sal
36.7 gr
30 ml de azucar
25.2 gr
Agar de hierro kligler
4.42 gr
BITACORA
Tiempo actividad
5 min portar equipo de bioseguridad
50 min medida de los materiales
5 min anotaciones
5 min retirar equipo de bioseguridad
CONCLUSION
La practica ya realizada anteriormente logro su objetivo, ya que el alumno se familiarizo y aprendio a utilizar la balanza granataria, asi como conocer los pesos de los instrumentos que se le proporciono.
Objetivo
Introducción
Desarrollo
Bitácora
Conclusión
Fuentes de consulta
OBJETIVO DE LA PRÁCTICA
En la práctica se tiene como principal objetivo el uso de la balanza, así como también que el alumno se familiarice con diversos instrumentos como (cristalería, entre otros). En la practica se quiere conocer los pesos del objeto o con un reactivo, esto con ayuda de la balanza granataria.
INTRODUCCION
Dicha práctica tiene el nombre de “Pesos y medidas” y se realiza con el fin de conocer medidas de los pesos correspondientes a los instrumentos dados. Para esto los instrumentos se pesaran en la balanza granataria, la cual debe estar balanceada, para tratar que el peso dado sea exacto y correcto. Esta práctica es el primer paso para la preparación del cultivo.
MARCO TEORICO
Material:
-Azúcar
-Sal
-vaso de pp50ml
-vaso de pp 500ml
-laminilla de cristal
-Caja de petri
-probeta
-tubo de ensayo
-vidrio de reloj
-cristalizador
-pipeta graduada 5ml
-pipeta volumétrica
-pipeta Pasteur
-pipeta de Salí
-manguera con boquilla
-espátula
-pipeta graduada
La práctica consiste en pesar en la balanza granataria los materiales indicados. Para ello primeramente debemos pedir el material necesario, observar si la balanza granataria esta bien balanceada y después empezar a pesar los instrumentos. Cada integrante del equipo deberá pesar por lo menos un material y anotar sus observaciones.
-Pasos
1. El alumno debe de portar su equipo de bioseguridad correctamente.
2. Observar si la balanza esta correctamente balanceada.
3. Colocar los instrumentos en la balanza y anotar su peso.
4. Se realizara el mismo procedimiento con los demás materiales.
5. Se pesa el vaso de pp. de 50 ml con azúcar primero y después con sal, así como vacio.
6. Por ultimo se registran los datos obtenidos.
7. Se limpian los instrumentos usados y se guardan en orden.
Pesos registrados.
Vaso de pp 50ml
28 gr
Vaso de pp 500ml
116gr
Laminilla de cristal
53.6gr
Caja petri
71 gr
Probeta graduada
145 gr
Tubo de ensayo
17.9 gr
Vidrio de reloj
55.4 gr
Cristalizador
21.8 gr
Volumetrica
22.6 gr
Pipeta pasteur
5.6 gr
Pipeta de Sali con manguera
7.3 gr
Espatula
49.5gr
Pipeta graduada de 1ml
3.4 gr
Agua destilada
5.4 gr
Sal
36.7 gr
30 ml de azucar
25.2 gr
Agar de hierro kligler
4.42 gr
BITACORA
Tiempo actividad
5 min portar equipo de bioseguridad
50 min medida de los materiales
5 min anotaciones
5 min retirar equipo de bioseguridad
CONCLUSION
La practica ya realizada anteriormente logro su objetivo, ya que el alumno se familiarizo y aprendio a utilizar la balanza granataria, asi como conocer los pesos de los instrumentos que se le proporciono.
CAMARA DE NEUBAUER
Recuento de eritrocitos: ejemplo
Observe que en la grilla de la cámara de Neubauer las áreas de recuento de eritrocitos y linfocitos son diferentes. Los glóbulos rojos se cuentan en las áreas coloreadas de rojo, mientras que los glóbulos blancos se cuentan en las áreas coloreadas de azul. Ten en cuenta que la grilla central tiene 25 cuadrados de 1mm x 1mm de área y 0.10 mm de profundidad. El factor de dilución es por tanto de 1:200. Convierte el número de glóbulos rojos contados en 5 cuadrados a nº glóbulos rojos/µl. (1 µl (microlitro) = 1 mm3 )
Como se hace?
La imagen de abajo simula el campo que esta viendo al microscopio con un objetivo de 45x. Solo es visible el centro de la grilla. Intenta verificar esto al ir moviendo el campo de derecha-izquierda y de arriba-abajo, como si de una pletina de microscopio se tratase. Cuenta los glóbulos rojos en los cinco cuadrados mencionados anteriormente y determina el recuento de eritrocitos como se ha descrito anteriormente..
Muy importante: Cuando un eritrocito se sitúa en mitad de las líneas superior y/o de la izquierda, entonces es contabilizado. Pero no se contabiliza cuando se sitúa en mitad de las líneas inferior y/o de la derecha..
El rango normal de recuento de glóbulos rojos es el siguiente:
Mujeres:
3.9-5.6 millones/µl
Hombres:
4.5-6.5 millones/µl
Determine el recuento del sujeto cuya muestra aparece en la imagen.
Cual es la solución?
Técnicas de estudio de líneas celulares
TÉCNICAS DE CONTAJE
CELULAR
Una suspensión celular se caracteriza por
presentar un número de partículas microscópicas dispersas en un fluido.
Habitualmente será necesario determinar tanto la densidad de las células en
la suspensión como el porcentaje de éstas que son viables.
Para determinar la densidad de las células se
emplean diferentes técnicas, desde la relativamente simple cámara de contaje
celular de la que existen numerosas variantes, entre ellas la que empleamos
(cámara de Neubauer), hasta equipos automáticos de contaje celular como el
"Cell Coulter" de la empresa
El principio del contador celular se basa en la
medida de los cambios en la resistencia eléctrica que se producen cuando
una partícula no conductora en suspensión en un electrolito atraviesa un
pequeño orificio. Como se puede ver en el esquema, una pequeña abertura entre
los electrodos es la zona sensible a través de la que pasan las partículas
que se encuentran en suspensión. Cuando una partícula atraviesa el orificio
desplaza su propio volumen de electrolito. El volumen desplazado es medido
como un pulso de voltaje. La altura de cada pulso es proporcional al
volumen de la partícula. controlando la cantidad de la suspensión que
circula a través del orificio es posible contar y medir el tamaño de las
partículas. Es posible contar y medir varios miles de partículas por segundo,
independientemente de su forma, color y densidad.
En la unidad de Citometría de flujo y
Microscopia Confocal de los
se dispone de contadores celulares.
Sin
embargo, es
posible determinar la densidad celular empleando métodos más sencillos. Nos
basta con una cámara de contaje celular, por ej. la cámara de Neubauer, y un
microscopio. Una cámara de contaje celular es un dispositivo en el que se
coloca una muestra de la suspensión a medir. El dispositivo presenta unas
señales que determinan un volumen conocido (x microlitros). Al contar bajo el
microscopio el número de partículas presentes en ese volumen se puede
determinar la densidad de partículas en la suspensión de origen.
La cámara de Neubauer es una cámara de contaje
adaptada al microscopio de campo claro o al de contraste de fases. Se trata
de un portaobjetos con una depresión en el centro, en el fondo de la cual
se ha marcado con la ayuda de un diamante una cuadrícula como la que se ve
en la imagen. Es un cuadrado de 3 x 3 mm, con una separación entre dos
lineas consecutivas de 0.25 mm. Así pues el área sombreada y marcada L
corresponde a 1 milimetro cuadrado. La depresión central del cubreobjetos
está hundida 0.1 mm respecto a la superficie, de forma que cuando se cubre
con un cubreobjetos éste dista de la superficie marcada 0.1 milímetro, y el
volumen comprendido entre la superficie L y el cubreobjetos es de 0.1
milímetro cúbico, es decir 0.1 microlitro.
Si contamos las cuatro áreas sombreada (L)
observando un total de x células entre las cuatro áreas, la concentración en
la suspensión celular será :
concentración en la suspensión (células / mL) =
10000 (x/4)
En la imagen puedes observar el aspecto de una
de las regiones marcadas como L y que en el microscopio se ven como una
cuadrícula de 16 pequeños cuadrados de 0.25 milímetros de lado. Esta imagen
ha sido tomada empleando un microscopio invertido de contraste de fases.
Existen numerosos modelos de cámaras de contaje
celular adaptadas a su uso en microscopía. En la imagen puedes observar una
cámara de Neubauer doble, como las que usas en el laboratorio de prácticas.
Para determinar la viabilidad celular se
emplean diferentes métodos. El más común es el de tinción con azul tripán.
El azul tripán es un coloide que se introduce en el interior de las células
que presentan roturas en la membrana. Así pues las células que aparecen en
la imagen, claramente de color azul, son consideradas no viables. Asimilar
células blancas, por exclusión, a células viables es un error pues por este
método se sobrevalora la viabilidad de las células en la suspensión,
determinando como inviables sólo aquellas con la membrana rota. Existen
otros métodos de determinación de la viabilidad celular como el más preciso
de la tinción con ioduro de
propidio
En la red dispones de descripciones detalladas
sobre como la propuesta por P.J. Hansen, o la detallada descripción que aporta
Beckton-Dickinson
, y los problemas de cálculo de
parámetros celulares que plantea empleando datos obtenidos a partir de un
hemocitómetro, y otros protocolos
para el contaje de células
(en protocol-online)
- arriba -
se aseptiza el dedo con alcohol y luego se seca
al aire o con algodón. Se coge entre el pulgar y el índice y se hace una
punción rápida y penetrante a través de la piel de la punta del dedo con una
lanceta estéril.
2. Se
deshecha la primera gota de sangre y se aspira la siguiente con la pipeta de
dilución perfectamente limpia y seca hasta la señal 1 o 0.5 (también puede
utilizarse la pipeta de hemoglobina, de 20 microlitros). Hay que evitar la
entrada de burbujas de aire, pudiendo ayudarnos de un papel de filtro para
conseguir el enrasado.
3. A
continuación se toma con la pipeta líquido de Hayem, isotónico con la sangre,
hasta la señal 1; así, la sangre queda diluida al 1/10, si tomamos sangre
hasta la señal 1, o al 1/20 si tomamos hasta 0.5. Esto es así porque el
volumen de la bola de la pipeta es 100 veces superior al del capilar de la
misma. (Si hemos utilizado la pipeta de hemoglobina podemos diluir su contenido
en 2 o 4 ml de líquido de Hayem para obtener diluciones 1/100 o 1/200).
4. Tomamos
la pipeta (o el tubo de ensayo) entre los dedos índice y pulgar y agitamos. A
través de la goma de conexión con la pipeta, soplamos para despreciar las
primeras gotas por corresponder al líquido que estaba en el capilar.
5. Se
adapta un cubreobjetos sobre una cámara cuentaglóbulos limpia y seca y se
coloca una gota en uno de los lados del cubre; esta gota penetra por
capilaridad y rellena el retículo de la misma.
6. Una
vez preparada la cámara se coloca sobre la platina del microscopio dejándose
unos minutos en reposo para que sedimenten los glóbulos. Disponemos el
condensador bajo y luz débil; enfocamos primero con el objetivo débil seco y
luego se cambia al fuerte seco para proceder al recuento, que se lleva a cabo
en los cuadrados pequeños del retículo marcado en color rojo. Finalizado
el recuento se procede a la limpieza de la pipeta con acético 1:3, agua
destilada y alcohol-éter sucesivamente.
7.El volumen
de sangre en el cual se han contado las células resulta de multiplicar la
profundidad de la cámara por el factor de dilución, la superficie de los
cuadrados y el número de cuadrados contados.
Con cámara de NEUBAUER:
Superficie de 1 cuadrado grande (1/20 mm de lado):
Volumen de un cuadrado
grande (1/10 mm de profundidad):
Si contamos
"a" glóbulos rojos en "n" cuadrados pequeños, el número
de glóbulos por cuadrado será a/n.
Si en un volumen 1/4000
mm3 hay a/n glóbulos rojos, en 1 mm3 habrá X. Luego:
siendo X el número de
glóbulos rojos existentes por cada mm3 de sangre diluida.
Si la sangre se
diluyó a 1/100 o 1/200, habrá que multiplicar el valor X por 100 o 200
respectivamente, con lo cual obtendremos un nuevo valor, Y, que representa el
número de glóbulos rojos existentes por cada mm3 de sangre (sin
diluir).
Se utilizan para calcular, mediante el uso del
microscopio, el número de partículas (leucocitos, hematíes, bacterias…) por
unidad de voluimen de un líquido.
La cámara está constituida por una placa base de
vidrio especial pareciso a un porta, su parte central se encuentra separada de
los extremos por unas ranuras. en ella se encuentran las cuadrículas de
recuento.
La fórmula de contaje es: partículas/mm3=
partículas contadas.
Clases de cámaras:
- Neubauer improved: Es el más utilizado (9
cuadros grandes, cada 1 de 1 mm2.)
- Neubauer: La diferencia es el cuadro grande
central.
- Thoma: Se utiliza solo para el recuento de
eritrocitos.
- Fuchs-Rosenthal: Se utiliza habitualmente para
recuento de células en líquidos orgánicos (LCR, Líquido sinovial…)
Observe que en la grilla de la cámara de Neubauer las áreas de recuento de eritrocitos y linfocitos son diferentes. Los glóbulos rojos se cuentan en las áreas coloreadas de rojo, mientras que los glóbulos blancos se cuentan en las áreas coloreadas de azul. Ten en cuenta que la grilla central tiene 25 cuadrados de 1mm x 1mm de área y 0.10 mm de profundidad. El factor de dilución es por tanto de 1:200. Convierte el número de glóbulos rojos contados en 5 cuadrados a nº glóbulos rojos/µl. (1 µl (microlitro) = 1 mm3 )
Como se hace?
La imagen de abajo simula el campo que esta viendo al microscopio con un objetivo de 45x. Solo es visible el centro de la grilla. Intenta verificar esto al ir moviendo el campo de derecha-izquierda y de arriba-abajo, como si de una pletina de microscopio se tratase. Cuenta los glóbulos rojos en los cinco cuadrados mencionados anteriormente y determina el recuento de eritrocitos como se ha descrito anteriormente..
Muy importante: Cuando un eritrocito se sitúa en mitad de las líneas superior y/o de la izquierda, entonces es contabilizado. Pero no se contabiliza cuando se sitúa en mitad de las líneas inferior y/o de la derecha..
El rango normal de recuento de glóbulos rojos es el siguiente:
Mujeres:
3.9-5.6 millones/µl
Hombres:
4.5-6.5 millones/µl
Determine el recuento del sujeto cuya muestra aparece en la imagen.
Cual es la solución?
Técnicas de estudio de líneas celulares
TÉCNICAS DE CONTAJE
CELULAR
Una suspensión celular se caracteriza por
presentar un número de partículas microscópicas dispersas en un fluido.
Habitualmente será necesario determinar tanto la densidad de las células en
la suspensión como el porcentaje de éstas que son viables.
Para determinar la densidad de las células se
emplean diferentes técnicas, desde la relativamente simple cámara de contaje
celular de la que existen numerosas variantes, entre ellas la que empleamos
(cámara de Neubauer), hasta equipos automáticos de contaje celular como el
"Cell Coulter" de la empresa
El principio del contador celular se basa en la
medida de los cambios en la resistencia eléctrica que se producen cuando
una partícula no conductora en suspensión en un electrolito atraviesa un
pequeño orificio. Como se puede ver en el esquema, una pequeña abertura entre
los electrodos es la zona sensible a través de la que pasan las partículas
que se encuentran en suspensión. Cuando una partícula atraviesa el orificio
desplaza su propio volumen de electrolito. El volumen desplazado es medido
como un pulso de voltaje. La altura de cada pulso es proporcional al
volumen de la partícula. controlando la cantidad de la suspensión que
circula a través del orificio es posible contar y medir el tamaño de las
partículas. Es posible contar y medir varios miles de partículas por segundo,
independientemente de su forma, color y densidad.
En la unidad de Citometría de flujo y
Microscopia Confocal de los
se dispone de contadores celulares.
Sin
embargo, es
posible determinar la densidad celular empleando métodos más sencillos. Nos
basta con una cámara de contaje celular, por ej. la cámara de Neubauer, y un
microscopio. Una cámara de contaje celular es un dispositivo en el que se
coloca una muestra de la suspensión a medir. El dispositivo presenta unas
señales que determinan un volumen conocido (x microlitros). Al contar bajo el
microscopio el número de partículas presentes en ese volumen se puede
determinar la densidad de partículas en la suspensión de origen.
La cámara de Neubauer es una cámara de contaje
adaptada al microscopio de campo claro o al de contraste de fases. Se trata
de un portaobjetos con una depresión en el centro, en el fondo de la cual
se ha marcado con la ayuda de un diamante una cuadrícula como la que se ve
en la imagen. Es un cuadrado de 3 x 3 mm, con una separación entre dos
lineas consecutivas de 0.25 mm. Así pues el área sombreada y marcada L
corresponde a 1 milimetro cuadrado. La depresión central del cubreobjetos
está hundida 0.1 mm respecto a la superficie, de forma que cuando se cubre
con un cubreobjetos éste dista de la superficie marcada 0.1 milímetro, y el
volumen comprendido entre la superficie L y el cubreobjetos es de 0.1
milímetro cúbico, es decir 0.1 microlitro.
Si contamos las cuatro áreas sombreada (L)
observando un total de x células entre las cuatro áreas, la concentración en
la suspensión celular será :
concentración en la suspensión (células / mL) =
10000 (x/4)
En la imagen puedes observar el aspecto de una
de las regiones marcadas como L y que en el microscopio se ven como una
cuadrícula de 16 pequeños cuadrados de 0.25 milímetros de lado. Esta imagen
ha sido tomada empleando un microscopio invertido de contraste de fases.
Existen numerosos modelos de cámaras de contaje
celular adaptadas a su uso en microscopía. En la imagen puedes observar una
cámara de Neubauer doble, como las que usas en el laboratorio de prácticas.
Para determinar la viabilidad celular se
emplean diferentes métodos. El más común es el de tinción con azul tripán.
El azul tripán es un coloide que se introduce en el interior de las células
que presentan roturas en la membrana. Así pues las células que aparecen en
la imagen, claramente de color azul, son consideradas no viables. Asimilar
células blancas, por exclusión, a células viables es un error pues por este
método se sobrevalora la viabilidad de las células en la suspensión,
determinando como inviables sólo aquellas con la membrana rota. Existen
otros métodos de determinación de la viabilidad celular como el más preciso
de la tinción con ioduro de
propidio
En la red dispones de descripciones detalladas
sobre como la propuesta por P.J. Hansen, o la detallada descripción que aporta
Beckton-Dickinson
, y los problemas de cálculo de
parámetros celulares que plantea empleando datos obtenidos a partir de un
hemocitómetro, y otros protocolos
para el contaje de células
(en protocol-online)
- arriba -
se aseptiza el dedo con alcohol y luego se seca
al aire o con algodón. Se coge entre el pulgar y el índice y se hace una
punción rápida y penetrante a través de la piel de la punta del dedo con una
lanceta estéril.
2. Se
deshecha la primera gota de sangre y se aspira la siguiente con la pipeta de
dilución perfectamente limpia y seca hasta la señal 1 o 0.5 (también puede
utilizarse la pipeta de hemoglobina, de 20 microlitros). Hay que evitar la
entrada de burbujas de aire, pudiendo ayudarnos de un papel de filtro para
conseguir el enrasado.
3. A
continuación se toma con la pipeta líquido de Hayem, isotónico con la sangre,
hasta la señal 1; así, la sangre queda diluida al 1/10, si tomamos sangre
hasta la señal 1, o al 1/20 si tomamos hasta 0.5. Esto es así porque el
volumen de la bola de la pipeta es 100 veces superior al del capilar de la
misma. (Si hemos utilizado la pipeta de hemoglobina podemos diluir su contenido
en 2 o 4 ml de líquido de Hayem para obtener diluciones 1/100 o 1/200).
4. Tomamos
la pipeta (o el tubo de ensayo) entre los dedos índice y pulgar y agitamos. A
través de la goma de conexión con la pipeta, soplamos para despreciar las
primeras gotas por corresponder al líquido que estaba en el capilar.
5. Se
adapta un cubreobjetos sobre una cámara cuentaglóbulos limpia y seca y se
coloca una gota en uno de los lados del cubre; esta gota penetra por
capilaridad y rellena el retículo de la misma.
6. Una
vez preparada la cámara se coloca sobre la platina del microscopio dejándose
unos minutos en reposo para que sedimenten los glóbulos. Disponemos el
condensador bajo y luz débil; enfocamos primero con el objetivo débil seco y
luego se cambia al fuerte seco para proceder al recuento, que se lleva a cabo
en los cuadrados pequeños del retículo marcado en color rojo. Finalizado
el recuento se procede a la limpieza de la pipeta con acético 1:3, agua
destilada y alcohol-éter sucesivamente.
7.El volumen
de sangre en el cual se han contado las células resulta de multiplicar la
profundidad de la cámara por el factor de dilución, la superficie de los
cuadrados y el número de cuadrados contados.
Con cámara de NEUBAUER:
Superficie de 1 cuadrado grande (1/20 mm de lado):
Volumen de un cuadrado
grande (1/10 mm de profundidad):
Si contamos
"a" glóbulos rojos en "n" cuadrados pequeños, el número
de glóbulos por cuadrado será a/n.
Si en un volumen 1/4000
mm3 hay a/n glóbulos rojos, en 1 mm3 habrá X. Luego:
siendo X el número de
glóbulos rojos existentes por cada mm3 de sangre diluida.
Si la sangre se
diluyó a 1/100 o 1/200, habrá que multiplicar el valor X por 100 o 200
respectivamente, con lo cual obtendremos un nuevo valor, Y, que representa el
número de glóbulos rojos existentes por cada mm3 de sangre (sin
diluir).
Se utilizan para calcular, mediante el uso del
microscopio, el número de partículas (leucocitos, hematíes, bacterias…) por
unidad de voluimen de un líquido.
La cámara está constituida por una placa base de
vidrio especial pareciso a un porta, su parte central se encuentra separada de
los extremos por unas ranuras. en ella se encuentran las cuadrículas de
recuento.
La fórmula de contaje es: partículas/mm3=
partículas contadas.
Clases de cámaras:
- Neubauer improved: Es el más utilizado (9
cuadros grandes, cada 1 de 1 mm2.)
- Neubauer: La diferencia es el cuadro grande
central.
- Thoma: Se utiliza solo para el recuento de
eritrocitos.
- Fuchs-Rosenthal: Se utiliza habitualmente para
recuento de células en líquidos orgánicos (LCR, Líquido sinovial…)
Suscribirse a:
Entradas (Atom)
